解答题-原理综合题 适中0.65 引用1 组卷57
CO、CO2对环境都会产生一定危害,但它们也是重要的化工原料,工业上利用CO、CO2催化加氢制取甲醇,主要发生以下反应:反应I:CO(g)+2H2(g) CH3OH(g) ΔH1;
CH3OH(g) ΔH1;
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
(1)一定温度、压强下,由稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。稳定单质的摩尔生成焓为0.已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-395kJ/mol、-201 kJ/mol、-242 kJ/mol,则在该条件下ΔH2=___________ 。
(2)在体系总压恒定为10kPa的密闭容器中,通入 3mol CO2和5mol H2发生反应Ⅱ,反应达平衡时,CO2转化率为50%,该温度下的平衡常数Kp=___________ (用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。平衡后再充入2.5molCO2和2.5molH2O(g),此时v正_______ v逆(填“>”“<”或“=”)。
(3)利用反应Ⅰ和Ⅱ合成CH3OH,若氢碳比表示为f= ,则理论上f=
,则理论上f=___________ 时,原料气的利用率最高。
(4)某实验小组研究T1、T2时CO与CO2间的转化,在密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,实验初始时体系中的c(CO)=c(H2O)、c (H2)=c(CO2),则平衡时lgc(CO)和lgc(H2)的关系如图所示。
CO2(g)+H2(g) ΔH<0,实验初始时体系中的c(CO)=c(H2O)、c (H2)=c(CO2),则平衡时lgc(CO)和lgc(H2)的关系如图所示。
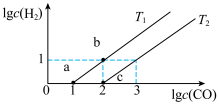
①根据图像判断:T1___________ T2 (填“>”“<”或“=”),T1时的平衡常数Kc=___________ 。
②由平衡状态a到b,改变的条件是___________ 。
(5)利用图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),
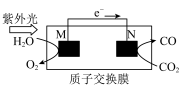
①该装置工作时,N电极的电极反应式为___________ 。
②导线中通过2mol电子后,假定体积不变,M极电解质溶液的pH___________ (填“增大”、“减小”或“不变”),N极电解质溶液质量的变化Δm=___________ g。
反应Ⅱ:CO2(g)+3H2(g)
(1)一定温度、压强下,由稳定单质生成1mol化合物的焓变称为该物质的摩尔生成焓。稳定单质的摩尔生成焓为0.已知CO2(g)、CH3OH(g)、H2O(g)的摩尔生成焓分别为-395kJ/mol、-201 kJ/mol、-242 kJ/mol,则在该条件下ΔH2=
(2)在体系总压恒定为10kPa的密闭容器中,通入 3mol CO2和5mol H2发生反应Ⅱ,反应达平衡时,CO2转化率为50%,该温度下的平衡常数Kp=
(3)利用反应Ⅰ和Ⅱ合成CH3OH,若氢碳比表示为f=
(4)某实验小组研究T1、T2时CO与CO2间的转化,在密闭容器中发生反应CO(g)+H2O(g)

①根据图像判断:T1
②由平衡状态a到b,改变的条件是
(5)利用图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),

①该装置工作时,N电极的电极反应式为
②导线中通过2mol电子后,假定体积不变,M极电解质溶液的pH
22-23高二下·辽宁朝阳·阶段练习
类题推荐
根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焓。根据此定义,稳定单质的摩尔生成焓为0,某些化合物的摩尔生成焓如下表所示:
CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为______________________
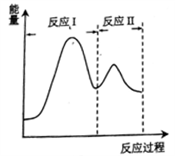
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图所示。则总反应的反应速率取决于反应_______ (填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)的平衡常数表达式Kp=
2CO(g)+2H2(g)的平衡常数表达式Kp= __________ (用平衡分压p代替平衡浓度表示)
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g ), 发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图所示。

① a点时CH 4的转化率为___________________________
② 压强p 1、p 2、p 3由大到小的顺序为________________ ,判断理由是______________________ 。温度为T l℃、压强为P 3时,b点处v(正) ________ v(逆)(填“<”、“>”或“="”)
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图所示,该电池负极的电极反应式为_____________________________________________ .若电极B附近通入1m 3空气(假设空气中O 2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH 4的体积为_______ m3

(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焓。根据此定义,稳定单质的摩尔生成焓为0,某些化合物的摩尔生成焓如下表所示:
| 化合物 | CO2 | CH4 | CO |
| 摩尔生成焓(kJ·mol-1) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图所示。则总反应的反应速率取决于反应

(3)一定温度下反应:CO2(g)+CH4(g)
 2CO(g)+2H2(g)的平衡常数表达式Kp=
2CO(g)+2H2(g)的平衡常数表达式Kp= (4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g ), 发生反应:CO2(g)+CH4(g)
 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图所示。
① a点时CH 4的转化率为
② 压强p 1、p 2、p 3由大到小的顺序为
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图所示,该电池负极的电极反应式为

为实现“碳达峰”、“碳中和”目标,可将CO2催化加氢制甲醇。该反应体系中涉及以下两个主要反应:
反应I: △H1<0
△H1<0
反应II: △H2>0
△H2>0
(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
则反应I的
_______ 。
(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
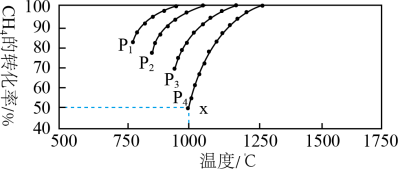
(3)向容器中加入1mol CO2、1mol H2,维持压强100kpa发生反应,CO2和H2的平衡转化率随温度变化曲线如图所示。

①曲线_______ (填“L1”或“L2”)表示CO2的平衡转化率。
②温度高于T2K后曲线L2随温度升高而降低的原因为_______ 。
③T1K下反应达到平衡时,H2O(g)的物质的量为_______ mol,反应I的标准平衡常数
_______ (保留1位小数)。(已知:分压=总压×该组分物质的量分数,对于反应: ,
, ,其中
,其中 ,
, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
(4)利用电催化可将CO2同时转化为多种燃料,装置如图:
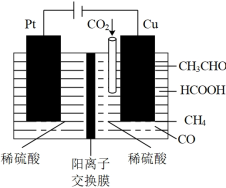
①铜电极上产生CH4的电极反应式为_______ 。
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为_______ 。
反应I:
反应II:
(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
| 物质 | H2(g) | CO2(g) | CH3OH(g) | H2O(g) |
0 | -393.5 | -201 | -241.8 |
(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
| A.增大压强,CO的浓度一定保持不变 |
| B.降低温度,反应II的逆反应速率增大,正反应速率减小 |
| C.增大 CH3OH的浓度,反应II的平衡向正反应方向移动 |
| D.恒温恒压下充入气,反应I的平衡向逆反应方向移动 |

①曲线
②温度高于T2K后曲线L2随温度升高而降低的原因为
③T1K下反应达到平衡时,H2O(g)的物质的量为
(4)利用电催化可将CO2同时转化为多种燃料,装置如图:

①铜电极上产生CH4的电极反应式为
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网