解答题-原理综合题 适中0.65 引用1 组卷167
2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向1L的刚性密闭容器中加入足量的C(s)和1molH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:
I.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4kJ•mol-1
CO(g)+H2(g) ΔH1=+131.4kJ•mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1kJ•mol-1
CO2(g)+H2(g) ΔH2=-41.1kJ•mol-1
①下列说法正确的是______ 。
A.平衡时向容器中充入惰性气体,反应I、Ⅱ的平衡均不移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数一定小于
D.增加碳块用量,可加快反应速率
②反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。此时,整个体系______ (填“吸收”或“放出”)热量_______ kJ,反应I的平衡常数Kc=_______ 。
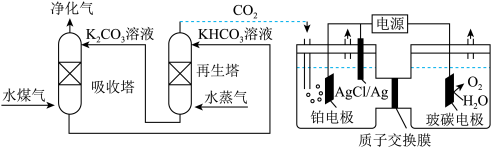
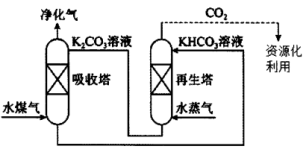
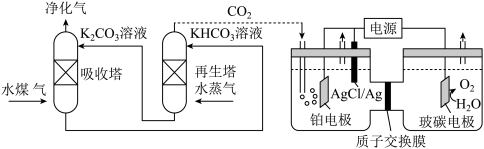
(2)一种脱除和利用水煤气中CO2方法的示意图如图:
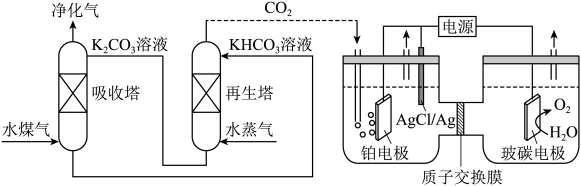
①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后溶液pH=10,则此时溶液中c(CO )∶c(HCO
)∶c(HCO )=
)=_____ (该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11)。
②再生塔中产生CO2的离子方程式为_______ 。
③利用电化学原理,将CO2电催化还原为C2H4的电极反应式为______ ;AgCl/Ag电极的质量______ (填变大、变小或不变);放电结束后,铂电极所在的区域溶液的pH_______ (填变大、变小或不变)。
(1)在一定温度下,向1L的刚性密闭容器中加入足量的C(s)和1molH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:
I.C(s)+H2O(g)
Ⅱ.CO(g)+H2O(g)
①下列说法正确的是
A.平衡时向容器中充入惰性气体,反应I、Ⅱ的平衡均不移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数一定小于
D.增加碳块用量,可加快反应速率
②反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
(2)一种脱除和利用水煤气中CO2方法的示意图如图:

①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后溶液pH=10,则此时溶液中c(CO
②再生塔中产生CO2的离子方程式为
③利用电化学原理,将CO2电催化还原为C2H4的电极反应式为
2023·陕西西安·一模
类题推荐
2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。
(1)已知:①H2O(g)= H2O(l) △H= -44 kJ/mol;
②部分物质的燃烧热如下表:
则反应C(s)+H2O(g)= CO(g)+H2(g)的△H =_______ kJ/mol。
(2)在一定温度下,向体积为2 L,的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
I.C(s)+H2O(g) CO(g)+H2(g) △H1
CO(g)+H2(g) △H1
II.CO(g)+H2O(g) CO2(g)+H2(g)△H2
CO2(g)+H2(g)△H2
①能说明容器中反应已达到平衡的标志是_______ (填字母序号)。
A.容器内气体的平均相对分子质量不变
B.混合气体的密度保持不变
C.v(H2O)消耗=v(H2)生成
D.生成CO和H2的物质的量之比为1:1
②反应10 min时达到平衡,此时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。反应10 min内的平均化学反应速率v(CO2)=_______ ; 此温度下反应I的平衡常数Kp=_______ ( 以分压表示,分压=总压×物质的量分数)。
(3)一种脱除和利用水煤气中CO2方法的示意图如下:
①某温度下,吸收塔中K2CO3溶液吸收一定 量的CO2后, c( ):c (
):c ( )=1:2,则该溶液的pH=
)=1:2,则该溶液的pH=________ ( 该温度下H2CO3的Ka1=4.6×10-7, K。a2=5.0 ×10-11) 。
②利用电化学原理,将CO2电催化还原为C2H4,阳极反应式为________ ,每消耗1 mol CO2转移的电子为_______ mol。
(1)已知:①H2O(g)= H2O(l) △H= -44 kJ/mol;
②部分物质的燃烧热如下表:
| 物质 | C(s) | CO(g) | H2(g) |
| 燃烧热/ (kJ/mol) | -393. 5 | -283. 0 | -285. 8 |
(2)在一定温度下,向体积为2 L,的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
I.C(s)+H2O(g)
II.CO(g)+H2O(g)
①能说明容器中反应已达到平衡的标志是
A.容器内气体的平均相对分子质量不变
B.混合气体的密度保持不变
C.v(H2O)消耗=v(H2)生成
D.生成CO和H2的物质的量之比为1:1
②反应10 min时达到平衡,此时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。反应10 min内的平均化学反应速率v(CO2)=
(3)一种脱除和利用水煤气中CO2方法的示意图如下:

①某温度下,吸收塔中K2CO3溶液吸收一定 量的CO2后, c(
②利用电化学原理,将CO2电催化还原为C2H4,阳极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网