解答题-原理综合题 适中0.65 引用1 组卷164
氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制备高纯氢的方法之一。
Ⅰ.一种利用太阳能催化该反应的原理如图1所示,以气体分压(单位为kPa)表示的各步反应的平衡常数( )与温度(T)变化关系如图2所示。
)与温度(T)变化关系如图2所示。
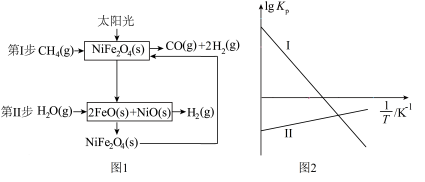
(1)根据图1分析该反应的催化剂为___________ 。
(2)甲烷水蒸气重整制氢反应 的
的
___________ 0(填“>”“<”或“=”),该反应在___________ (填“高温”或“低温”)条件下容易自发进行。
Ⅱ.甲烷水汽重整反应是我国主要的制氢技术,有关反应如下:
反应ⅰ:
 ;
;
反应ⅱ:
 。
。
(3)对于反应ⅰ,下列叙述正确的是___________(填标号)。
(4)一定温度下,向恒容密闭反应器中通入 和
和 ,起始时
,起始时 和
和 的分压分别为
的分压分别为 、
、 ,发生反应ⅰ和反应ⅱ。反应进行
,发生反应ⅰ和反应ⅱ。反应进行 时达到平衡状态,此时
时达到平衡状态,此时 、
、 的分压分别为
的分压分别为 、
、 。
。
① 的平衡分压为
的平衡分压为___________ MPa(用含m,n的代数式表示,下同)。
②反应ⅱ的
___________ (用平衡时各物质的分压代替物质的量浓度)。
③复合载氧体可以氧化甲烷制取合成气( 、
、 ),如图为350℃时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应ⅲ:
),如图为350℃时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应ⅲ: 或反应ⅳ:
或反应ⅳ: ]。
]。
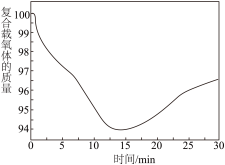
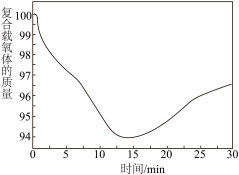
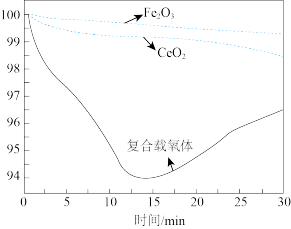
从开始到 的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在
的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在 时,出现了一个短暂的小平台,其主要的原因是
时,出现了一个短暂的小平台,其主要的原因是___________ 。
Ⅰ.一种利用太阳能催化该反应的原理如图1所示,以气体分压(单位为kPa)表示的各步反应的平衡常数(

(1)根据图1分析该反应的催化剂为
(2)甲烷水蒸气重整制氢反应
Ⅱ.甲烷水汽重整反应是我国主要的制氢技术,有关反应如下:
反应ⅰ:
反应ⅱ:
(3)对于反应ⅰ,下列叙述正确的是___________(填标号)。
| A.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率增大 |
| B.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率增大 |
| C.恒温、恒容条件下,加入惰性气体,压强增大, |
| D.加入合适的催化剂,同时降低反应温度,能实现单位时间内转化率不变 |
①
②反应ⅱ的
③复合载氧体可以氧化甲烷制取合成气(

从开始到
22-23高二下·湖北武汉·期末
类题推荐
甲烷水汽重整反应是我国主要的制氢技术,有关反应如下:
反应i: ;
;
反应ii: 。
。
回答下列问题:
反应 、反应
、反应 的平衡常数分别为
的平衡常数分别为 、
、 ,反应温度为
,反应温度为 。
。
(1)b_____ (填“<”或“>”)0.
(2)对于反应i, ,
, (
( 、
、 为速率常数,仅与温度有关)。向等压密闭容器中充入
为速率常数,仅与温度有关)。向等压密闭容器中充入 、
、 仅发生反应
仅发生反应 ,达到平衡后生成
,达到平衡后生成 和
和 。下列说法不正确的是_____(填标号)。
。下列说法不正确的是_____(填标号)。
(3)一定温度下,向恒容密闭反应器中通入 和
和 ,起始时
,起始时 和
和 的分压分别为
的分压分别为 、
、 ,发生反应
,发生反应 和反应ii.反应进行
和反应ii.反应进行 时达到平衡状态,此时
时达到平衡状态,此时 、
、 的分压分别为
的分压分别为 、
、 。
。
① 的平衡分压为
的平衡分压为_____  用含
用含 的代数式表示,下同)。
的代数式表示,下同)。
②反应ii的
_____ (用平衡时各物质的分压代替物质的量浓度)。
(4)复合载氧体可以氧化甲烷制取合成气 、
、 ,如图为
,如图为 时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应iii:
时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应iii: 或反应iv:
或反应iv: 。
。
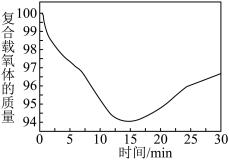
①从开始到 的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在
的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在 时,出现了一个短暂的小平台,其主要的原因是
时,出现了一个短暂的小平台,其主要的原因是_____ 。
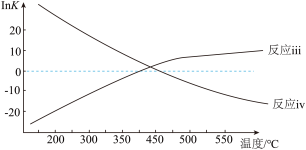
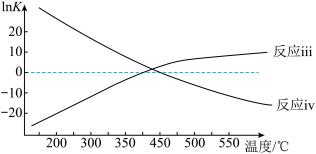
②已知 ,反应iii和反应iv的
,反应iii和反应iv的 与温度的关系如图所示,则
与温度的关系如图所示,则 时,主要发生的积碳反应是
时,主要发生的积碳反应是_____ ,共理由是_____ 。
(5)在混合导体透氧膜反应器中只需一步就可同时制备氨合成气 和液体燃料合成气
和液体燃料合成气 ,其工作原理如图所示。
,其工作原理如图所示。
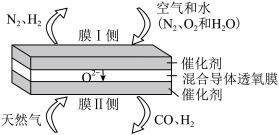
①膜I侧发生的反应为 、
、_____ 。
②膜II侧相当于原电池的_____ 极,膜II侧发生的反应为_____ 。
反应i:
反应ii:
回答下列问题:
反应
(1)b
(2)对于反应i,
| A. |
| B.及时分离出 |
| C.1000°C时,k正一定小于k逆 |
| D.其他条件不变,达平衡后再向容器中充入 |
①
②反应ii的
(4)复合载氧体可以氧化甲烷制取合成气

①从开始到
②已知

(5)在混合导体透氧膜反应器中只需一步就可同时制备氨合成气

①膜I侧发生的反应为
②膜II侧相当于原电池的
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网