填空题 适中0.65 引用2 组卷153
某种牛奶的营养成分表如下所示(NRV%是指每100g食品中营养素的含量占该营养素每日摄入量的比例)。
回答下列问题。
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是___________ (填元素名称)。
(2)Na在元素周期表中的位置是___________ ,它与氧元素形成的常见化合物中含有非极性共价键,其电子式为___________ 。
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)___________ r(O2-);②沸点:NH3___________ CH4
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| 营养成分表 | ||
| 项目 | 每100g | NRV% |
| 能量 | 309kJ | 4% |
| 蛋白质 | 3.6g | 4% |
| 脂肪 | 4.4g | 7% |
| 碳水化合物 | 5.0g | 2% |
| 钠 | 65mg | 3% |
| 钙 | 120mg | 15% |
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是
(2)Na在元素周期表中的位置是
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| Ca | Mg | |
| 操作 | 取绿豆大小的一块钙投入盛有水的 | 将打磨后的镁条投入盛有冷水的试管中。 |
| 现象 | 钙先沉入水中,表面产生大量气体,一段时间后上浮,溶液变浑浊。 | 一段时间后,镁条表面有细小气泡产生。 |
| 描述或推测 | ①钙密度比水大; ②溶液中产生的沉淀主要是 | 由细小气泡猜测Mg可能与水发生反应,还需要补充的实验操作及现象是 |
| 结论 | 钙能与水反应生成沉淀和氢气,且反应剧烈。 | 镁能与水缓慢反应,化学方程式为 |
22-23高二下·四川成都·期末
类题推荐
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。表中列出了钙元素及a~f6种元素在周期表中的位置。
(1)a的元素符号是____ ;e的最高价氧化物是____ 。
(2)c、d的最高价氧化物对应的水化物中,碱性较弱的物质是____ (写化学式)。
(3)用电子式表示c与f组成的化合物的形成过程____ 。
(4)非金属性b强于e,用原子结构解释原因____ 。
(5)下列关于f及其化合物的推断中,正确的是____ (填字母)。
a.f的最高化合价均为+7价
b.f单质的氧化性在同主族中最强
c.f的最高价氧化物对应的水化物的溶液pH<7
(6)某种牛奶的营养成分表如表所示。
①营养成分表中,所含物质质量最大的是____ 。
②已知镁能与O2、H2O反应,对比钙与镁的原子结构和在元素周期表中的位置关系,你预测金属钙的性质是____ 。
③请结合钙的化学性质判断牛奶中钙的存在形式为____ (填“单质”或“化合物”)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | ||||
| 4 | Ca |
(2)c、d的最高价氧化物对应的水化物中,碱性较弱的物质是
(3)用电子式表示c与f组成的化合物的形成过程
(4)非金属性b强于e,用原子结构解释原因
(5)下列关于f及其化合物的推断中,正确的是
a.f的最高化合价均为+7价
b.f单质的氧化性在同主族中最强
c.f的最高价氧化物对应的水化物的溶液pH<7
(6)某种牛奶的营养成分表如表所示。
| 营养成分表 | ||
| 项目 | 每100g | NRV% |
| 能量 | 309kJ | 4% |
| 蛋白质 | 3.6g | 6% |
| 脂肪 | 4.4g | 7% |
| 碳水化合物 | 5.0g | 2% |
| 钠 | 65mg | 3% |
| 钙 | 120mg | 15% |
②已知镁能与O2、H2O反应,对比钙与镁的原子结构和在元素周期表中的位置关系,你预测金属钙的性质是
③请结合钙的化学性质判断牛奶中钙的存在形式为
家中的食品、调味品、洗涤剂和药品等都含有化学物质,以下是胃药和加碘食盐的标签,回答下列问题。
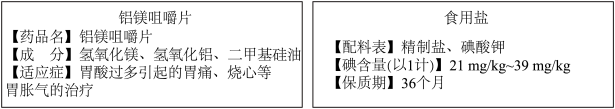
(1)标签中涉及到的金属元素有Na、Mg、Al、K,非金属元素有_______ 、_______ 、C、Si、Cl、I(填元素符号);Mg在元素周期表中的位置是_______ ,K原子结构示意图为_______ 。
(2)以上非金属元素位于同主族的有_______ (填元素名称)。
(3)以上非金属元素分别与氧形成的共价化合物中,含有非极性共价键的是_______ (填化学式)。
(4)比较下列性质,用“>”、“=”或“<”填空。
①酸性:
_______  。
。
②还原性:
_______  。
。
(5)用以下对比实验探究Mg、Al的金属性强弱以及Cl、I的非金属性强弱。

(1)标签中涉及到的金属元素有Na、Mg、Al、K,非金属元素有
(2)以上非金属元素位于同主族的有
(3)以上非金属元素分别与氧形成的共价化合物中,含有非极性共价键的是
(4)比较下列性质,用“>”、“=”或“<”填空。
①酸性:
②还原性:
(5)用以下对比实验探究Mg、Al的金属性强弱以及Cl、I的非金属性强弱。
| 比较Mg、Al金属性强弱 | 比较Cl、I非金属性强弱 |
| 选择试剂:冷水、酚酞 | 选择的试剂:新制氯水、KI溶液 |
| 操作:将打磨好的镁片和铝片 | 操作:向盛有4mLKI溶液的试管中加入1mL氯水,振荡 |
| 现象:Mg片表面逐渐产生气泡,溶液变为浅红色,铝片的表面和溶液无明显变化 | 现象: 离子方程式: |
| 结论:金属性Mg强于Al | 结论:非金属性Cl强于I |
某小组想通过实验探究 Na、Mg、Al 三种金属元素性质的递变规律。
I.探究 Na、Mg、Al 分别与水反应的情况。
实验①:切一小块绿豆大小的金属 Na,用滤纸吸干其表面的煤油,将其投入盛有 100ml 水(含酚酞)的烧杯中。观察到 Na 与冷水发生剧烈反应,烧杯内溶液变红。
(1)与水反应生成氢氧化钠和氢气,写出该反应的化学方程式___________ 。
(2)上述反应中,作还原剂的是___________ 。
A.Na B.H2O C.NaOH
(3)上述反应中若有23克金属Na被充分反应,则产生气体在标况下的体积约为___________ L。
(4)溶液中,使酚酞试液变红的微粒是___________ 。
A.Na+ B.H+ C.OH-
实验②:分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 2ml 水,再滴入2 滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③:另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验 操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 Al 与水反应现象仍不明显。
(5)实验②的设计中未考虑到的因素是___________ 。
(6)通过上述实验,得出 Na、Mg、Al 的金属性由强到弱的顺序是___________ 。
Ⅱ.比较 NaOH、Mg(OH)2、Al(OH)3碱性的强弱。
实验④:在试管中加入2ml 0.5mol·L-1 Al2(SO4)3溶液,然后逐滴滴加 2mol·L-1 NaOH溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤:在试管中加入2ml 1mol·L-1 MgSO4溶液,然后逐滴滴加2mol·L-1 NaOH 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
(7)写出由实验④、⑤的实验现象可推导得出的结论。
(8)综上实验可知,NaOH、Mg(OH)2、Al(OH)3的碱性由强到弱的顺序是___________ 。
I.探究 Na、Mg、Al 分别与水反应的情况。
实验①:切一小块绿豆大小的金属 Na,用滤纸吸干其表面的煤油,将其投入盛有 100ml 水(含酚酞)的烧杯中。观察到 Na 与冷水发生剧烈反应,烧杯内溶液变红。
(1)与水反应生成氢氧化钠和氢气,写出该反应的化学方程式
(2)上述反应中,作还原剂的是
A.Na B.H2O C.NaOH
(3)上述反应中若有23克金属Na被充分反应,则产生气体在标况下的体积约为
(4)溶液中,使酚酞试液变红的微粒是
A.Na+ B.H+ C.OH-
实验②:分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 2ml 水,再滴入2 滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③:另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验 操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 Al 与水反应现象仍不明显。
(5)实验②的设计中未考虑到的因素是
(6)通过上述实验,得出 Na、Mg、Al 的金属性由强到弱的顺序是
Ⅱ.比较 NaOH、Mg(OH)2、Al(OH)3碱性的强弱。
实验④:在试管中加入2ml 0.5mol·L-1 Al2(SO4)3溶液,然后逐滴滴加 2mol·L-1 NaOH溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤:在试管中加入2ml 1mol·L-1 MgSO4溶液,然后逐滴滴加2mol·L-1 NaOH 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
(7)写出由实验④、⑤的实验现象可推导得出的结论。
| 现象 | 结论 | |
| ④ | 出现白色沉淀 | Al(OH)3的碱性比NaOH弱 |
| 沉淀全部溶解 | ||
| ⑤ | 出现白色沉淀 | |
| 沉淀不溶解 | Mg(OH)2无酸性 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


