解答题-实验探究题 适中0.65 引用2 组卷146
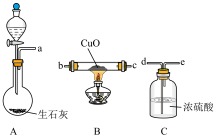
某化学兴趣小组用如图装置(夹持和加热装置已省略)来研究乙醇催化氧化的实验。

回答下列问题:
(1)A中热水可实现均匀加热,使_______ 挥发;C中U形管收集到的液体中,含有的有机物为_______ (填名称)。
(2)B中氧化铜生成铜的化学方程式为_______ 。
(3)反应结束后,硬质玻璃管中黑色固体全部变红,查阅资料得知:氧化亚铜 为红色固体,可以发生反应:
为红色固体,可以发生反应: 。同学们对反应结束后的红色固体成分提出猜想。
。同学们对反应结束后的红色固体成分提出猜想。
猜想1:固体为铜
猜想2:固体为氧化亚铜
猜想3:固体为铜和氧化亚铜的混合物
①甲同学取少量反应后的固体,加入足量的稀硫酸中,固体部分溶解,溶液变蓝,则猜想_______ 不成立。
②乙同学取少量反应后的固体,加入稀硝酸中,固体全部溶解,得出猜想2成立,其他同学对此提出质疑,理由是_______ 。
③在老师的指导下,丙同学取20 g反应后的固体于试管中,加入足量稀硫酸,充分反应后,过滤、_______ 、干燥,称量得知干燥后的固体为18 g,得出猜想_______ 成立。

回答下列问题:
(1)A中热水可实现均匀加热,使
(2)B中氧化铜生成铜的化学方程式为
(3)反应结束后,硬质玻璃管中黑色固体全部变红,查阅资料得知:氧化亚铜
猜想1:固体为铜
猜想2:固体为氧化亚铜
猜想3:固体为铜和氧化亚铜的混合物
①甲同学取少量反应后的固体,加入足量的稀硫酸中,固体部分溶解,溶液变蓝,则猜想
②乙同学取少量反应后的固体,加入稀硝酸中,固体全部溶解,得出猜想2成立,其他同学对此提出质疑,理由是
③在老师的指导下,丙同学取20 g反应后的固体于试管中,加入足量稀硫酸,充分反应后,过滤、
22-23高一下·广东云浮·期末
类题推荐
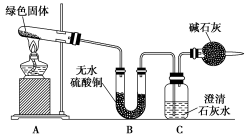
某课题组设计实验探究铜和浓硫酸的反应。实验装置如图所示。

实验操作和现象如下:
回答下列问题:
(1)点燃酒精灯之前,通入氮气的目的是______ 。
(2)A装置导出的SO2气体中混有水蒸气和____ 。
(3)B装置中HCl的作用是______ 。
(4)实验完毕后,取出烧瓶中固体,设计实验探究其成分。查阅资料知,浓硫酸与铜反应可能生成CuS和Cu2S,它们都是难溶于水,也难溶于稀盐酸、稀硫酸的黑色固体,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,残余固体呈黑色。
(ii)取少量残余黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变蓝色,产生无色气泡。取少量上层清液于试管中,滴加氯化钡溶液,产生白色沉淀。
(iii)另取m g残余黑色固体进行如图实验:
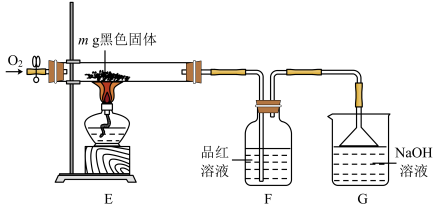
通入足量O2,加热,使硬质玻璃管中的黑色固体充分反应,观察到F瓶中溶液由红色变无色。称得反应后硬质玻璃管中的黑色物质仍然为mg。
①由实验(i)得到蓝色溶液知,烧瓶中固体含有_____ (填化学式)。
②由实验(ii)能否得出黑色固体成分是CuS或Cu2S或二者的混合物,_____ (填“能”或“否”),理由是_______ 。
③烧瓶中固体不可能含CuO,理由是______ 。
④由实验(iii)得出黑色固体是______ (填化学式)。写出E中发生反应的化学方程式:_______ 。

实验操作和现象如下:
| 实验操作 | 现象 |
| 加热之前,打开夹子K,通入一段时间N2,关闭K,点燃酒精灯 | A装置烧瓶中产生大量白雾;B中产生白色沉淀;C中溶液褪色 |
回答下列问题:
(1)点燃酒精灯之前,通入氮气的目的是
(2)A装置导出的SO2气体中混有水蒸气和
(3)B装置中HCl的作用是
(4)实验完毕后,取出烧瓶中固体,设计实验探究其成分。查阅资料知,浓硫酸与铜反应可能生成CuS和Cu2S,它们都是难溶于水,也难溶于稀盐酸、稀硫酸的黑色固体,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,残余固体呈黑色。
(ii)取少量残余黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变蓝色,产生无色气泡。取少量上层清液于试管中,滴加氯化钡溶液,产生白色沉淀。
(iii)另取m g残余黑色固体进行如图实验:
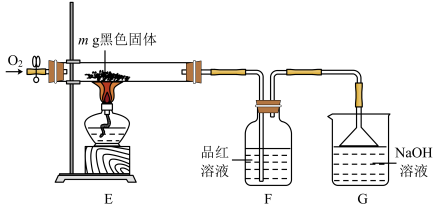
通入足量O2,加热,使硬质玻璃管中的黑色固体充分反应,观察到F瓶中溶液由红色变无色。称得反应后硬质玻璃管中的黑色物质仍然为mg。
①由实验(i)得到蓝色溶液知,烧瓶中固体含有
②由实验(ii)能否得出黑色固体成分是CuS或Cu2S或二者的混合物,
③烧瓶中固体不可能含CuO,理由是
④由实验(iii)得出黑色固体是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网