解答题-原理综合题 较难0.4 引用1 组卷91
近日,我国建成首个“西氢东送”输氢管道示范工程。目前,市面上绝大多数氢气是灰氢,约占当今全球氢气产量的95%。灰氢主要是通过煤炭、天然气等制备合成气,再分离出氢气,也可以利用合成气(CO,H2)制备C1、C2等化工产品。
已知:“灰氢”制备主要原理如下:
反应1:
反应2:
(1)已知:①
②
③
④
反应2中
_________  。
。
(2)乙醇是一种清洁能源和化工原料。工业上利用合成气合成乙醇: 。
。
①一定温度下,在某恒容密闭容器中充入 和2molH2(g)仅发生上述反应。下列说法正确的是
和2molH2(g)仅发生上述反应。下列说法正确的是________ (填字母)。
A.当混合气体的密度不再随时间变化时达到平衡
B.当混合气体的平均摩尔质量不再随时间变化时达到平衡
C.平衡时 的体积分数小于25%
的体积分数小于25%
D.其他条件不变,增大投料比 ,CO的平衡转化率增大
,CO的平衡转化率增大
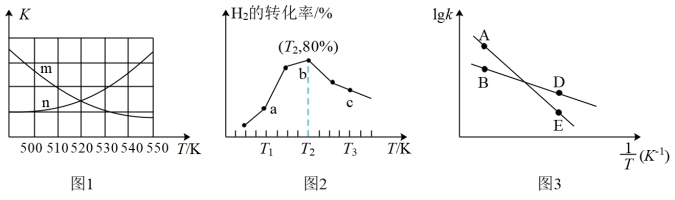
②对于该反应,不同温度对CO的平衡转化率 及催化剂的效率影响如图1所示。
及催化剂的效率影响如图1所示。

M点的平衡常数________ (填“大于”“小于”或“等于”)N点的平衡常数;其他条件不变,不加催化剂,则250℃时CO的平衡转化率________ (填“可能”或“不可能”)移至M1点。
(3)T℃时,在VL恒容密闭容器中充入6molCO(g)和8molH2(g),只发生反应: 。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
。初始压强为140kPa,测得H2的物质的量与时间的变化关系如图2中状态Ⅰ。图中坐标点A(1,6.5)表示1min时H2的物质的量为6.5mol。
①T℃时,该反应平衡时的总压强为________ ,该反应的压强平衡常数
________  (结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
(结果保留两位有效数字,Kp为用分压计算的平衡常数,分压=总压×物质的量分数)。
②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间的变化关系分别如图2中状态Ⅱ和Ⅲ所示,则状态________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)的平衡常数最小。
已知:“灰氢”制备主要原理如下:
反应1:
反应2:
(1)已知:①
②
③
④
反应2中
(2)乙醇是一种清洁能源和化工原料。工业上利用合成气合成乙醇:
①一定温度下,在某恒容密闭容器中充入
A.当混合气体的密度不再随时间变化时达到平衡
B.当混合气体的平均摩尔质量不再随时间变化时达到平衡
C.平衡时
D.其他条件不变,增大投料比
②对于该反应,不同温度对CO的平衡转化率

M点的平衡常数
(3)T℃时,在VL恒容密闭容器中充入6molCO(g)和8molH2(g),只发生反应:
①T℃时,该反应平衡时的总压强为
②其他条件不变,仅改变某一条件后,测得H2的物质的量随时间的变化关系分别如图2中状态Ⅱ和Ⅲ所示,则状态
22-23高二下·河南平顶山·期末
类题推荐
甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知:几种热化学方程式如下、其中,a、b、c都大于0。
①2CO(g)+O2(g)=2CO2(g) △H1=-akJ•mol-1;
②2H2(g)+O2(g)=2H2O(g) △H2=-bkJ•mol-1;
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=-ckJ•mol-1
则上述反应中的△H=______ kJ•mol-1。
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g),下列叙述正确的是
CH3OH(g),下列叙述正确的是______ (填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:CH3OH(g) CO(g)+2H2(g),其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。
CO(g)+2H2(g),其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。
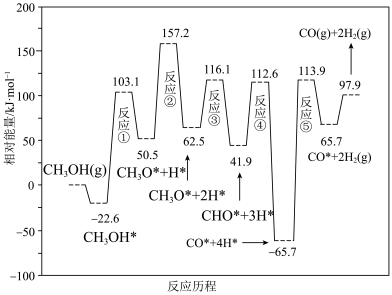
总反应经历5步反应中,最大能垒为______ kJ•mol-1,写出该步反应式:______ 。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH。发生反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g)(主反应);
CH3OH(g)+H2O(g)(主反应);
②2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)(主反应);
CH3CH2OH(g)+3H2O(g)(主反应);
③CO2(g)+H2(g) CO(g)+H2O(g)(副反应)。
CO(g)+H2O(g)(副反应)。
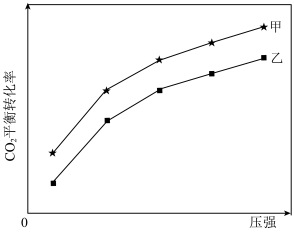
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2(g)和3molH2(g),发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是_______ ;采用水分子膜分离技术的容器是______ (填“甲”或“乙”)。
(5)一定温度下,向总压强恒定为100kPa的反应器中充入1molCO2(g)和3molH2(g),发生(4)中反应①②③,达到平衡时CO2转化率为50%,甲醇选择性为 ,生成0.05molCH3CH2OH,则反应①的平衡常数Kp为
,生成0.05molCH3CH2OH,则反应①的平衡常数Kp为______ (kPa)-2(写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数Kp,分压=总压×物质的量分数;甲醇选择性:η(CH3OH)= ×100%]。
×100%]。
(1)工业上利用合成气合成甲醇:CO(g)+2H2(g)
已知:几种热化学方程式如下、其中,a、b、c都大于0。
①2CO(g)+O2(g)=2CO2(g) △H1=-akJ•mol-1;
②2H2(g)+O2(g)=2H2O(g) △H2=-bkJ•mol-1;
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=-ckJ•mol-1
则上述反应中的△H=
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:CO(g)+2H2(g)
| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡向左移动 |
| C.平衡后再充入0.1molCO和0.1molH2,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:CH3OH(g)

总反应经历5步反应中,最大能垒为
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH。发生反应如下:
①CO2(g)+3H2(g)
②2CO2(g)+6H2(g)
③CO2(g)+H2(g)
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2(g)和3molH2(g),发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是

(5)一定温度下,向总压强恒定为100kPa的反应器中充入1molCO2(g)和3molH2(g),发生(4)中反应①②③,达到平衡时CO2转化率为50%,甲醇选择性为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网