解答题-原理综合题 适中0.65 引用2 组卷105
填空。
(1)在一个容积不变的 密闭容器中加入
密闭容器中加入 和合适的催化剂,发生反应
和合适的催化剂,发生反应 ,反应温度对
,反应温度对 的平衡转化率[
的平衡转化率[ 的平衡转化率
的平衡转化率 ]和催化剂的催化效率的影响如下图所示。
]和催化剂的催化效率的影响如下图所示。
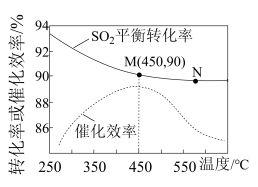
①在催化剂作用下合成 的最佳温度为
的最佳温度为___________ (填标号)。
A. B.
B. C.
C.
② 时,若经过
时,若经过 反应达到平衡,则
反应达到平衡,则 内用
内用 表示的平均反应速率为
表示的平均反应速率为________ 。
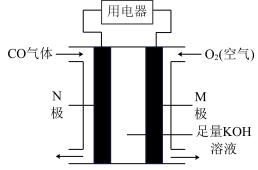
(2)某实验小组结合原电池原理设计了如图所示的燃料电池装置, 极为
极为___________ 极(填“正”或“负”),M极的电极反应式为___________ 。
(3) 气体在一定条件下可被氧气氧化,反应的化学方程式为
气体在一定条件下可被氧气氧化,反应的化学方程式为 。已知:键能是指气态分子中
。已知:键能是指气态分子中 化学键断裂成气态原子所吸收的能量,试利用下表中键能数据计算上述反应中有
化学键断裂成气态原子所吸收的能量,试利用下表中键能数据计算上述反应中有 被氧化时,该反应
被氧化时,该反应___________ (填“吸收”或“放出”)的能量为___________ 。
(4)向温度、体积均相同的两个恒容密闭容器中均充入 ,在不同催化剂下发生反应:
,在不同催化剂下发生反应: ,测得不同催化剂下氨气浓度随时间的变化如下表所示。
,测得不同催化剂下氨气浓度随时间的变化如下表所示。
对比可知,催化效果较好的是催化剂___________ 除催化剂外,对于该反应,请写出一种加快反应速率的方法:___________ 。
(1)在一个容积不变的

①在催化剂作用下合成
A.
②
(2)某实验小组结合原电池原理设计了如图所示的燃料电池装置,

(3)
| 共价键 | ||||
| 键能 | 366 | 498 | 464 | 193 |
| 编号 | 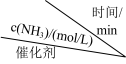 | 0 | 20 | 40 | 60 | 80 |
| ① | 催化剂1 | 0.00 | 0.40 | 0.78 | 1.13 | 1.44 |
| ② | 催化剂2 | 0.00 | 0.20 | 0.38 | 0.54 | 0.67 |
22-23高一下·河南南阳·期末
类题推荐
空间站 还原转化系统能把呼出的
还原转化系统能把呼出的 捕集、分离并与空间站电解水系统产生的
捕集、分离并与空间站电解水系统产生的 进行加氢处理,从而实现空间站内物料的循环利用。
进行加氢处理,从而实现空间站内物料的循环利用。
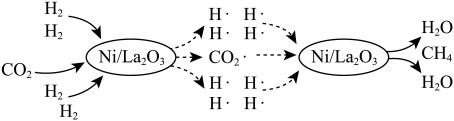
(1)一种借助光将 转化为
转化为 的催化机理如图所示。该转化过程总反应的化学方程式是
的催化机理如图所示。该转化过程总反应的化学方程式是_______ ;图中所示的各物质中,含有极性共价键的非极性分子是_______ (填化学式)。
(2)一定条件下, 和
和 还可发生如下两个平行反应:
还可发生如下两个平行反应:
i.

ii.

①已知相关键能数据如下表:
则反应i的
_______  。
。
②为了提高 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是_______ (填标号)。
A.低温低压 B.高温低压 C.高温高压 D.低温高压
③保持温度 ,压强
,压强 ,按投料比
,按投料比 向密闭容器中充入
向密闭容器中充入 和
和 ,反应相同时间测得不同催化剂下
,反应相同时间测得不同催化剂下 转化率和
转化率和 选择性的相关实验数据如下表所示(已知
选择性的相关实验数据如下表所示(已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比)。
的百分比)。
上述条件下,使用cat.2作催化剂,下列说法能判断反应ii达到平衡状态的是_______ (填标号)。
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C. 和
和 的物质的量之比为
的物质的量之比为 D.
D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化
(3)一定条件下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,只发生上述反应ii,达平衡时,
,只发生上述反应ii,达平衡时, 的转化率为80%,则该温度下的平衡常数
的转化率为80%,则该温度下的平衡常数
_______ (保留两位小数)。
(4)若恒容密闭容器中只发生上述反应i,在进气比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度
_______  (填“<”,“>”,或“=”),其原因是
(填“<”,“>”,或“=”),其原因是_______ 。

(1)一种借助光将

(2)一定条件下,
i.
ii.
①已知相关键能数据如下表:
| 化学键 | ||||
| 键能/ | 436 | 464 | 803 | 1072 |
②为了提高
A.低温低压 B.高温低压 C.高温高压 D.低温高压
③保持温度
| 催化剂 | ||
| cat.1 | 21.9% | 67.3% |
| cat.2 | 36.1% | 100.0% |
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C.
(3)一定条件下,向
(4)若恒容密闭容器中只发生上述反应i,在进气比

化学反应伴随能量变化,获取反应能量变化有多种途径。
I.
(1)下列反应中,属于吸热反应的是_______(填字母)。
II.获取能量变化的途径
(2)通过化学键的键能计算。
已知:

下表列出了3种化学键的键能:
①
_______ 
②该反应经历了如下反应历程:第一步 第二步
第二步
若第一步为快反应,下列示意图中能体现上述反应能量变化的是_______ (填标号)。
A. B.
B.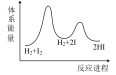 C.
C. D.
D.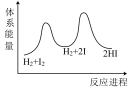
③下列可证明反应 已达平衡状态的是
已达平衡状态的是_______ (填标号)。
A.一个I—I键断裂的同时有两个H—I键断裂
B.反应速率
C.温度和体积一定时,混合气体颜色不再变化
D.条件一定时,混合气体的平均相对分子质量不再变化
(3)通过盖斯定律可计算。
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下
)在催化剂作用下可合成甲醇,发生的主要反应如下
i.

ii.

iii.


_______ 。
(4)将2.0mol 和3.0mol
和3.0mol 通入容积为3L的恒容密闭容器中,在一定条件下发生反应ii,测得
通入容积为3L的恒容密闭容器中,在一定条件下发生反应ii,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
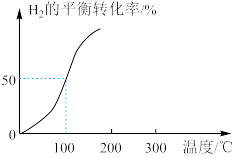
①100℃时反应ii达到平衡所需的时间为5min,则反应从起始至5min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为_______ 。
②100℃时,反应ii的平衡常数K=_______ 。
③已知:反应ii的瞬时速率表达式为 ,
, (k为速率常数,只与温度有关)]。温度由100℃升高到300℃,活化分子百分数
(k为速率常数,只与温度有关)]。温度由100℃升高到300℃,活化分子百分数_____ (填“增大”“减小”或“不变”)。300℃时,
______ (填“大于”“小于”或“等于”)K(100℃)。
I.
(1)下列反应中,属于吸热反应的是_______(填字母)。
| A.钠与水反应 | B.甲烷的燃烧反应 |
| C. | D.二氧化碳与焦炭反应 |
II.获取能量变化的途径
(2)通过化学键的键能计算。
已知:
下表列出了3种化学键的键能:
| 化学键 | H—H | I—I | H—I |
| 键能/( | 436 | 151 | 299 |
①
②该反应经历了如下反应历程:第一步
若第一步为快反应,下列示意图中能体现上述反应能量变化的是
A.
 B.
B. C.
C. D.
D.
③下列可证明反应
A.一个I—I键断裂的同时有两个H—I键断裂
B.反应速率
C.温度和体积一定时,混合气体颜色不再变化
D.条件一定时,混合气体的平均相对分子质量不再变化
(3)通过盖斯定律可计算。
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、
i.
ii.
iii.
(4)将2.0mol

①100℃时反应ii达到平衡所需的时间为5min,则反应从起始至5min内,用
②100℃时,反应ii的平衡常数K=
③已知:反应ii的瞬时速率表达式为
一种借助光将CO2转化为CH4的催化机理如图所示。
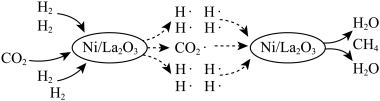
(1)该转化过程总反应的化学方程式是_______ ;图中所示的各物质中,含有极性共价键的非极性分子是_______ (填化学式)。
一定条件下,CO2和H2还可发生如下两个平行反应:
i. CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1
ii. CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H2=-49.5 kJ·mol-1
已知相关物质的总键能数据如表:
(2)则反应i的∆H1= _______ kJ·mol-1。
(3)为了提高CH3OH的产率,理论上应采用的措施是_______(填标号)。
(4)保持温度为533 K,压强为3 Mpa,按投料比 向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如下表所示(已知CH3OH选择性为转化的CO2中生成CH3OH的物质的量的百分比)。
向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如下表所示(已知CH3OH选择性为转化的CO2中生成CH3OH的物质的量的百分比)。
上述条件下,使用Cat.2催化剂,下列说法能判断反应ii达到平衡状态的是_______(填标号)。
(5)一定条件下,向0.5 L恒容密闭容器中充入1 mol CO2和 3 mol H2,只发生上述反应ii,达平衡时,H2的转化率为80%,则该温度下的平衡常数K= _______ (保留两位小数)。
(6)若恒容密闭容器中只发生上述反应i,在进气比 不同、温度不同时,测得相应的CO2平衡转化率如图所示。则B和C两点的温度TB
不同、温度不同时,测得相应的CO2平衡转化率如图所示。则B和C两点的温度TB _______ TC (填“<”,“>”,或“=”),其原因是_______ 。


(1)该转化过程总反应的化学方程式是
一定条件下,CO2和H2还可发生如下两个平行反应:
i. CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1
ii. CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H2=-49.5 kJ·mol-1
已知相关物质的总键能数据如表:
| 物质 | H2 | H2O | CO2 | CO |
| 键能(kJ·mol-1) | 436 | 928 | 1606 | 1072 |
(3)为了提高CH3OH的产率,理论上应采用的措施是_______(填标号)。
| A.低温低压 | B.高温低压 | C.高温高压 | D.低温高压 |
| 催化剂 | CO2转化率 | CH3OH选择性 |
| Cat.1 | 21.9% | 67.3% |
| Cat.2 | 36.1% | 100.0% |
| A.气体压强不再变化 | B.气体平均相对分子质量不再变化 |
| C.CH3OH和H2O的物质的量之比为1:1 | D.CO2和H2的物质的量之比不再变化 |
(6)若恒容密闭容器中只发生上述反应i,在进气比

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


