解答题-原理综合题 较难0.4 引用2 组卷420
回答下列问题:
Ⅰ.工业上利用甲醇和水蒸气催化重整法可制备氢气。
(1)已知:反应1:CH3OH(g) CO(g)+2H2(g)∆H1=+90.0kJ·mol-1
CO(g)+2H2(g)∆H1=+90.0kJ·mol-1
反应2:CO(g)+H2O(g) CO2(g)+H2(g)∆H2=-41.0kJ·mol-1
CO2(g)+H2(g)∆H2=-41.0kJ·mol-1
则反应3:CH3OH(g)+H2O(g) CO2(g)+3H2(g)∆H3=
CO2(g)+3H2(g)∆H3=___________ kJ·mol-1
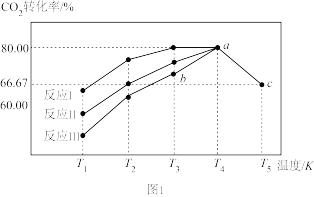
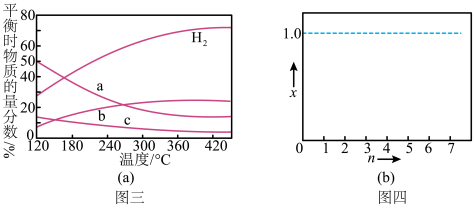
(2)以CuO-ZnO-Al2O3催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及CO选择性的影响如图1所示。[CO选择性= ]
]
①当水、甲醇比大于0.8时,CO选择性下降的原因是___________ 。
②当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是___________ 。
(3)在t℃下,在1L密闭容器中,当投入的CH3OH和H2O均为1mol时,甲醇平衡转化率为80%、CO选择性为60%,则c(CO)=___________ mol·L-1。
Ⅱ.用CO2和H2可以合成甲醇。其主要反应为
反应ⅠCO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应ⅡCO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
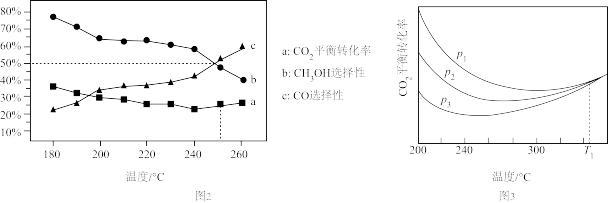
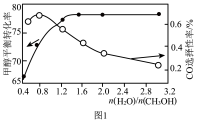
在恒容密闭容器内,充入1molCO2和3molH2,测得平衡时CO2转化率,CO和CH3OH选择性随温度变化如图2所示[选择性 ]。
]。
(4)270℃时主要发生的反应是___________ (填“Ⅰ”或“Ⅱ”)。
(5)以下温度中,甲醇产率最高的是___________。
(6)在不改变投料的情况下,既能加快反应速率,又能提高CH3OH产率的方法有___________ (填一种方法即可)。
Ⅰ.工业上利用甲醇和水蒸气催化重整法可制备氢气。
(1)已知:反应1:CH3OH(g)
反应2:CO(g)+H2O(g)
则反应3:CH3OH(g)+H2O(g)
(2)以CuO-ZnO-Al2O3催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及CO选择性的影响如图1所示。[CO选择性=

①当水、甲醇比大于0.8时,CO选择性下降的原因是
②当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是
(3)在t℃下,在1L密闭容器中,当投入的CH3OH和H2O均为1mol时,甲醇平衡转化率为80%、CO选择性为60%,则c(CO)=
Ⅱ.用CO2和H2可以合成甲醇。其主要反应为
反应ⅠCO2(g)+3H2(g)
反应ⅡCO2(g)+H2(g)
在恒容密闭容器内,充入1molCO2和3molH2,测得平衡时CO2转化率,CO和CH3OH选择性随温度变化如图2所示[选择性

(4)270℃时主要发生的反应是
(5)以下温度中,甲醇产率最高的是___________。
| A.210℃ | B.230℃ | C.250℃ | D.270℃ |
22-23高一下·江苏南京·期末
类题推荐
利用含CO2的工业废气为碳源合成甲醇(CH3OH),既可减少碳排放,又为甲醇的合成提供一条绿色新途径。其中主要反应为:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-48.9kJ•mol-1
CH3OH(g)+H2O(g) △H1=-48.9kJ•mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ•mol-1
CO(g)+H2O(g) △H2=+41.2kJ•mol-1
回答下列问题:
(1)CO(g)+2H2(g) CH3OH(g)的反应热△H=
CH3OH(g)的反应热△H=_____ kJ•mol-1。
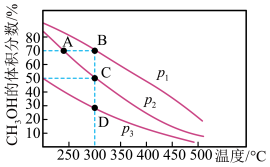
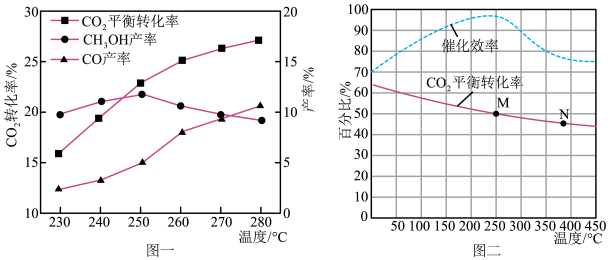
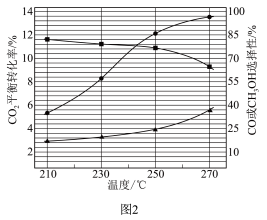
(2)在553K,恒容下进行反应,测得反应物投料比n(H2):n(CO2)对CO2平衡转化率的影响如图1所示。随着投料比的增大,CO2转化率增大的原因为_____ 。
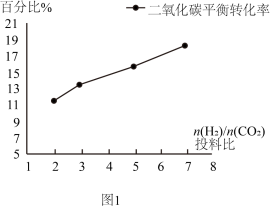
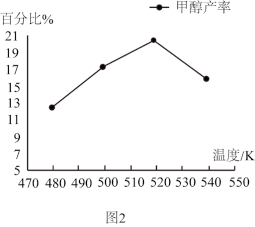
(3)其他条件不变时,测得单位时间内甲醇产率随反应温度的变化如图2所示,请解释温度低于520K时,甲醇产率的变化原因______ 。
(4)除改变投料比、温度外,能提高甲醇平衡产率的方法还有_____ (任写一种)。
(5)不同催化剂对CO2合成甲醇反应的影响如表所示:
①结合表中数据,选择催化剂______ (填标号)的效果最好。
②经研究发现,某催化剂能使上述合成只发生主反应。某温度下,往2L恒容容器中充入1molCO2、3molH2进行主反应,测得平衡时容器内c(CH3OH)=0.3mol/L,计算该温度下平衡常数K=_____ (结果保留整数)。若维持其他条件不变,改为在2L恒容绝热容器中发生反应,则甲醇的平衡产率将_____ (填“增大”、“减小”或“不变”)。
主反应:CO2(g)+3H2(g)
副反应:CO2(g)+H2(g)
回答下列问题:
(1)CO(g)+2H2(g)
(2)在553K,恒容下进行反应,测得反应物投料比n(H2):n(CO2)对CO2平衡转化率的影响如图1所示。随着投料比的增大,CO2转化率增大的原因为

(3)其他条件不变时,测得单位时间内甲醇产率随反应温度的变化如图2所示,请解释温度低于520K时,甲醇产率的变化原因

(4)除改变投料比、温度外,能提高甲醇平衡产率的方法还有
(5)不同催化剂对CO2合成甲醇反应的影响如表所示:
| 催化剂种类 | 催化剂组成 | 单位时间内甲醇产量 | 甲醇选择性/% |
| A | CuO/ZnO/Al2O3 | 78 | 40 |
| B | CuO/ZnO/ZrO2 | 96 | 88 |
| C | CuO/ZnO/ZrO2/MnO2 | 138 | 91 |
①结合表中数据,选择催化剂
②经研究发现,某催化剂能使上述合成只发生主反应。某温度下,往2L恒容容器中充入1molCO2、3molH2进行主反应,测得平衡时容器内c(CH3OH)=0.3mol/L,计算该温度下平衡常数K=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网