解答题-结构与性质 适中0.65 引用1 组卷237
硫、铬、铁、铜等元素分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。回答下列问题。
(1)硫元素在周期表中的位置为___________ 。
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如下图所示。
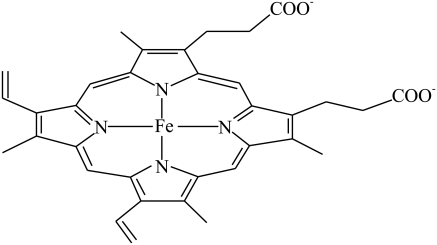
①血红蛋白中铁(II)的配位数为___________ ;
②基态Fe2+的核外价层电子排布式为___________ 。
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行________ 实验;加热该物质时,首先失去的是H2O分子,原因是________ 。
(5)金属晶体铜的晶胞如图所示。铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏加德罗常数。
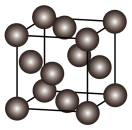
①Cu原子周围紧邻的Cu原子数目是___________ 。
②铜的相对原子质量为___________ (用a、ρ、NA表示,写出计算式即可)。
(1)硫元素在周期表中的位置为
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
| A.[Ar]3d54s1 | B.[Ar]3d44s14p1 | C.[Ar]3d5 | D.[Ar]3d54p1 |

①血红蛋白中铁(II)的配位数为
②基态Fe2+的核外价层电子排布式为
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行
(5)金属晶体铜的晶胞如图所示。铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏加德罗常数。

①Cu原子周围紧邻的Cu原子数目是
②铜的相对原子质量为
22-23高二下·重庆江津·期末
类题推荐
铜及其化合物在能源、信息等领域应用广泛。回答下列问题:
(1)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是 (填字母)。
(2)铜的熔点比同周期钾的熔点高,这是由于________ 。
(3)用超临界CO2/CH3CN及水作电解质,使用碳作载体的铜基催化剂可高效将CO2还原为HCOOH。CO2的空间结构为_____ ,CH3CN 中C原子的杂化方式为 _________ 。
(4)[Cu(NH3)4]2+是Cu2+常见的配离子,1 mol [Cu(NH3)4]2+中所含σ键数目为_________ ;[Cu(NH3)4]2+中H-N-H的键角比NH3中H- N- H的键角_____ (填“大”“小”或“无法判断”),原因是______ 。
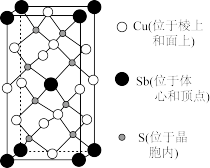
(5)一种热电材料的晶胞结构如图所示,底部边长为apm的正方形,高为cpm,该晶体的化学式为___ ,紧邻的 Sb与Cu间的距离为______ pm,设NA为阿伏加德罗常数的值,晶体的密度为_____ g· cm-3(列出计算表达式)。
(1)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是 (填字母)。
| A.④②①③ | B.④②③① |
| C.①②④③ | D.①④③② |
(3)用超临界CO2/CH3CN及水作电解质,使用碳作载体的铜基催化剂可高效将CO2还原为HCOOH。CO2的空间结构为
(4)[Cu(NH3)4]2+是Cu2+常见的配离子,1 mol [Cu(NH3)4]2+中所含σ键数目为
(5)一种热电材料的晶胞结构如图所示,底部边长为apm的正方形,高为cpm,该晶体的化学式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





