解答题-工业流程题 适中0.65 引用2 组卷181
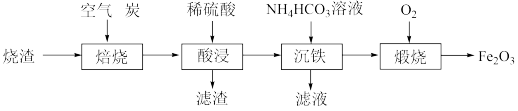
铁红(Fe2O3)是一种用途广泛的颜料,用某烧渣(主要成分为 ,含少量
,含少量 )制备铁红的流程如下:
)制备铁红的流程如下: 还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是
还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是_______ 。
(2)“酸浸”时,生成 的离子方程式为
的离子方程式为_______ 。
(3)“沉铁”时,除了生成 白色沉淀,还生成一种气体,该气体为
白色沉淀,还生成一种气体,该气体为_______ 。(填化学式)
(4)“煅烧”时,在一定温度下加热颗粒状 。一段时间后所得产物有两种成分,其中外层产物为
。一段时间后所得产物有两种成分,其中外层产物为 ,内层产物为
,内层产物为 。从受热的温度和接触的气体分析,产生该现象的可能原因是
。从受热的温度和接触的气体分析,产生该现象的可能原因是_______ 。
(5)产品中 的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的
的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的 溶液,发生反应
溶液,发生反应 ,充分反应后,除去其中过量
,充分反应后,除去其中过量 ;再向锥形瓶中逐滴加入0.1000mol·L
;再向锥形瓶中逐滴加入0.1000mol·L
 溶液,发生反应
溶液,发生反应 ,恰好完全反应时消耗
,恰好完全反应时消耗 溶液18.75mL。计算产品中
溶液18.75mL。计算产品中 的质量分数
的质量分数_______ 。(写出计算过程)
(2)“酸浸”时,生成
(3)“沉铁”时,除了生成
(4)“煅烧”时,在一定温度下加热颗粒状
(5)产品中
22-23高一下·江苏扬州·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





