解答题-原理综合题 适中0.65 引用2 组卷173
氢能是一种极具发展潜力的清洁能源。
(1)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。该反应的热化学方程式为: △H=
△H=_______ kJ·mol
(2)甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为: 。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol CH4(g)和2 mol H2O(g),反应过程中测得CO2的浓度与反应时间的关系如下表所示:
。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol CH4(g)和2 mol H2O(g),反应过程中测得CO2的浓度与反应时间的关系如下表所示:
①0〜4s时间段内用H2表示该反应的速率v(H2)=_______ mol·L-1·s-1,反应到5 s时,CH4的转化率为_______ 。
②下列措施可以使该反应速率加快的是_______ 。(填字母)
A.升高温度 B.减小甲烷的浓度 C.使用合适的催化剂
③下列能判断该反应已经达到化学平衡状态的是_______ 。(填字母)
A.CH4的浓度不再变化
B.生成2 mol CO2的同时生成1 mol H2O
C.容器内气体的密度不再发生变化
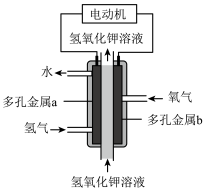
(3)某氢氧燃料电池已经成功应用在城市公交汽车上,其原理如图所示。工作时的总反应为: ,正极的电极反应式为
,正极的电极反应式为_______ 。
(1)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。该反应的热化学方程式为:
(2)甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.0 | 5.0 | 9.0 | 12.0 | 14.0 | 15.0 |
②下列措施可以使该反应速率加快的是
A.升高温度 B.减小甲烷的浓度 C.使用合适的催化剂
③下列能判断该反应已经达到化学平衡状态的是
A.CH4的浓度不再变化
B.生成2 mol CO2的同时生成1 mol H2O
C.容器内气体的密度不再发生变化
(3)某氢氧燃料电池已经成功应用在城市公交汽车上,其原理如图所示。工作时的总反应为:
22-23高一下·江苏扬州·期末
类题推荐
现代社会中,人类的一切活动都离不开能量。氢能是一种极具发展潜力的清洁能源。
Ⅰ.已知太阳光分解水制氢气的热化学方程式:
 kJ⋅mol
kJ⋅mol 。
。
(1)反应中主要能量转化形式为____ 能转化为____ 能。
(2)若在反应中使用催化剂,
______ 。(请填写“增大”“减小”或“不变”)
Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为: 。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol
。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol  和2 mol
和2 mol ,反应过程中测得
,反应过程中测得 的浓度与反应时间的关系如下表所示:
的浓度与反应时间的关系如下表所示:
(3)101 kPa时,1 mol  气体完全燃烧生成液态水和
气体完全燃烧生成液态水和 气体,放出890.3 kJ的热量,反应的热化学方程式为
气体,放出890.3 kJ的热量,反应的热化学方程式为______ 。
(4)①0~4s时间段内用 表示该反应速率
表示该反应速率
_____ mol⋅L ⋅S
⋅S ,反应到5s时,
,反应到5s时, 的转化率为
的转化率为_____ 。
②下列能判断该反应已经达到化学平衡状态的是_____ 。(填字母)
A. 的浓度不再变化 B.生成1 mol
的浓度不再变化 B.生成1 mol  的同时消耗2 mol
的同时消耗2 mol 
C.容器内气体的密度不再发生变化 D.容器内气体的平均摩尔质量不再发生变化
Ⅰ.已知太阳光分解水制氢气的热化学方程式:
(1)反应中主要能量转化形式为
(2)若在反应中使用催化剂,
Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.00 | 0.05 | 0.09 | 0.12 | 0.14 | 0.15 |
(4)①0~4s时间段内用
②下列能判断该反应已经达到化学平衡状态的是
A.
C.容器内气体的密度不再发生变化 D.容器内气体的平均摩尔质量不再发生变化
现代社会中,人类的一切活动都离不开能量。氢能是一种极具发展潜力的清洁能源。
Ⅰ.已知热化学方程式:
 (太阳光分解水制氢气)
(太阳光分解水制氢气)
(1)反应中主要能量转化形式为__________ 能转化为__________ 能。
(2)若在反应中使用催化剂,
__________ 。(选填“增大”“减小”或“不变”)
Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为: 。一定温度下,向体积为1L的恒容密闭容器中充入
。一定温度下,向体积为1L的恒容密闭容器中充入 和
和 ,反应过程中测得
,反应过程中测得 的浓度与反应时间的关系如下表所示:
的浓度与反应时间的关系如下表所示:
(3)101KPa时, 气体完全燃烧生成液态水和
气体完全燃烧生成液态水和 气体,放出890.3KJ的热量,反应的热化学方程式为
气体,放出890.3KJ的热量,反应的热化学方程式为________________________________________ 。
(4)①0~4s时间段内用 表示该反应速率
表示该反应速率
__________  ,反应到5s时,
,反应到5s时, 的转化率为
的转化率为__________ 。
②下列能判断该反应已经达到化学平衡状态的是__________ 。(填字母)
A. 的浓度不再变化
的浓度不再变化
B.生成 的同时生成
的同时生成
C.容器内气体的密度不再发生变化
(5) 燃料电池如图所示,放电时,氧化产物依次为
燃料电池如图所示,放电时,氧化产物依次为 、
、 。
。
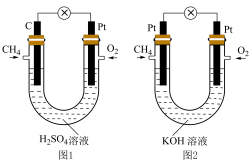
①图1中Pt极为__________ (填“正”或“负”)极。
②若消耗等物质的量的 ,则图1、图2装置中通过外电路的电子数之比为
,则图1、图2装置中通过外电路的电子数之比为__________ 。
Ⅰ.已知热化学方程式:
(1)反应中主要能量转化形式为
(2)若在反应中使用催化剂,
Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
0.0 | 5.0 | 9.0 | 12.0 | 14.0 | 15.0 |
(3)101KPa时,
(4)①0~4s时间段内用
②下列能判断该反应已经达到化学平衡状态的是
A.
B.生成
C.容器内气体的密度不再发生变化
(5)

①图1中Pt极为
②若消耗等物质的量的
在容积为2L的恒温容器中,充入1molCO2和3molH2,一定条件下发生反应 ,测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
,测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
(1)3~6min内,v(H2)=_______ mol·L-1·min-1,上表中x=_______ ,反应达平衡时,CO2的转化率为_______
(2)一定温度条件下,能够说明该反应到达平衡的标志是_______ 。(填序号)
①恒容条件下,混合气体的密度保持不变;
②单位时间内生成amolCO2,同时消耗3amolH2;
③CH3OH与H2O的浓度比不变
④CH3OH的物质的量不再变化;
(3)下列措施能增大该反应的化学反应速率的是_______。(填字母)
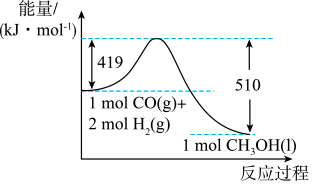
(4)CH3OH还可以直接由CO和H2制得,根据下图所示的转化关系判断,生成1molCH3OH(l)____ (填“吸收”或“放出”)的热量为____ kJ能量。_______ 。
②若线路中转移0.4mol电子,则该燃料电池理论上消耗的O2的体积(在标准状况下)为_______ L。
| 时间 | 0min | 3min | 6min | 9min | 12min |
| n(CH3OH)/mol | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
| n(CO2)/mol | 1 | 0.50 | 0.35 | x | 0.25 |
(1)3~6min内,v(H2)=
(2)一定温度条件下,能够说明该反应到达平衡的标志是
①恒容条件下,混合气体的密度保持不变;
②单位时间内生成amolCO2,同时消耗3amolH2;
③CH3OH与H2O的浓度比不变
④CH3OH的物质的量不再变化;
(3)下列措施能增大该反应的化学反应速率的是_______。(填字母)
| A.升高温度 | B.降低压强 |
| C.减小CH3OH的浓度 | D.加入合适的催化剂 |
(4)CH3OH还可以直接由CO和H2制得,根据下图所示的转化关系判断,生成1molCH3OH(l)
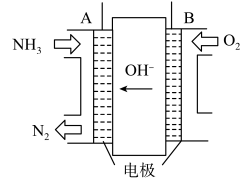
②若线路中转移0.4mol电子,则该燃料电池理论上消耗的O2的体积(在标准状况下)为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


