解答题-实验探究题 适中0.65 引用1 组卷132
利用浊度计探究一定条件下反应物浓度对硫代硫酸钠( )溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
)溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
反应原理:
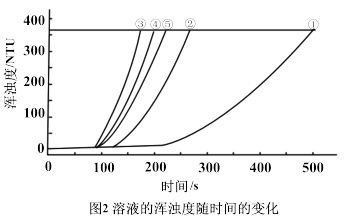
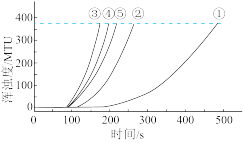
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。
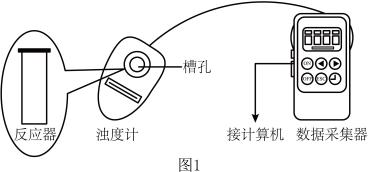
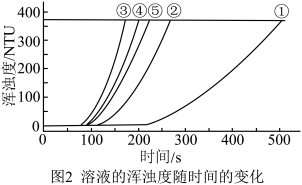
(1)
______ 。
(2)实验①③的目的是__________________ 。
(3)分析数据可得以下三个结论:
结论1:其它条件相同时, 浓度越大,反应速率越大;
浓度越大,反应速率越大;
①结论2:______________________________ ;
②结论3:其它条件相同时, 浓度改变对反应速率的影响程度大于
浓度改变对反应速率的影响程度大于 浓度改变对反应速率的影响程度。证据是
浓度改变对反应速率的影响程度。证据是________________________ 。
(4)已知浑浊度为375NTU时,产生S的质量为 g,则实验①反应开始到500s,用
g,则实验①反应开始到500s,用 浓度变化表示的平均反应速率为
浓度变化表示的平均反应速率为______  。
。
反应原理:
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。


| 实验编号 | 蒸馏水 | ||||
| V/mL | V/mL | V/mL | |||
| ① | 0.1 | 1.5 | 0.1 | V1 | 10 |
| ② | 0.1 | 2.5 | 0.1 | V2 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | 8 |
| ④ | 0.1 | V3 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | V4 | 0.1 | 1.5 | 10 |
(2)实验①③的目的是
(3)分析数据可得以下三个结论:
结论1:其它条件相同时,
①结论2:
②结论3:其它条件相同时,
(4)已知浑浊度为375NTU时,产生S的质量为
22-23高一下·宁夏吴忠·期末
类题推荐
探究一定条件下反应物浓度对硫代硫酸钠(Na2S2O3)与硫酸反应速率的影响。
【查阅资料】
a.Na2S2O3易溶于水,能与硫酸发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】


用如图所示装置进行如表所示的 5 个实验,分别测量混合后溶液达到相同浑浊度的过程中, 浑浊度随时间的变化。实验①~⑤所得数据如图曲线①~⑤所示:
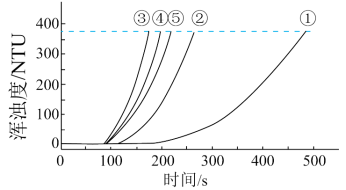
实验数据:
【分析与解释】
(1)实验序号①中,溶液混合后Na2S2O3溶液的初始浓度______ mol/L。
(2)实验③中,x =______ 。
(3)实验①、②、③的目的是______ 。
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对Na2S2O3与硫酸反应的化学反应速率的影响,Na2S2O3溶液浓度的改变影响更大。该推断的证据是______ 。
【查阅资料】
a.Na2S2O3易溶于水,能与硫酸发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】


用如图所示装置进行如表所示的 5 个实验,分别测量混合后溶液达到相同浑浊度的过程中, 浑浊度随时间的变化。实验①~⑤所得数据如图曲线①~⑤所示:

实验数据:
| 实验编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | ||
| c / (mol·L-1) | V / mL | c / (mol·L-1) | V / mL | V / mL | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
【分析与解释】
(1)实验序号①中,溶液混合后Na2S2O3溶液的初始浓度
(2)实验③中,x =
(3)实验①、②、③的目的是
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对Na2S2O3与硫酸反应的化学反应速率的影响,Na2S2O3溶液浓度的改变影响更大。该推断的证据是
探究一定条件下反应物浓度对硫代硫酸钠 与硫酸反应速率的影响。
与硫酸反应速率的影响。
【查阅资料】a. 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: 
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
实验数据:
(1)选用浊度计进行测量,原因是 溶液与
溶液与 溶液反应生成了
溶液反应生成了___________ 。
(2)实验③中,x=___________ 。
(3)实验①、②、③的目的是___________ 。
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是___________ 。
【查阅资料】a.
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】

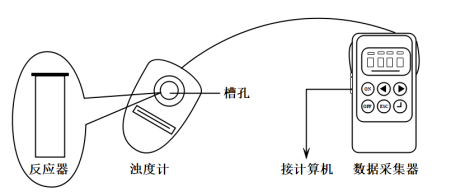
| 实验装置 | 蒸馏水 | ||||
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
(1)选用浊度计进行测量,原因是
(2)实验③中,x=
(3)实验①、②、③的目的是
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对
探究一定条件下反应物浓度对硫代硫酸钠(Na2S2O3)与硫酸反应速率的影响。
【查阅资料】a.Na2S2O3易溶于水,能与硫酸发生反应;
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】

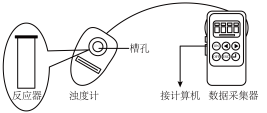
用如图所示装置进行如表所示的 5 个实验,分别测量混合后溶液达到相同浑浊度的过程中, 浑浊度随时间的变化。实验①~⑤所得数据如图曲线①~⑤所示及分组实验数据:
【分析与解释】
(1)实验序号①中,Na2S2O3写出与硫酸的化学反应方程式_______ ;溶液混合后Na2S2O3溶液的初始浓度_______ mol/L。
(2)实验③中,x =_______ 。
(3)实验①、②、③的目的是_______ 。
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对Na2S2O3与硫酸反应的化学反应速率的影响,Na2S2O3溶液浓度的改变影响更大。该推断的证据是_______ 。
实验二:以Fe3+与I-反应生成Fe2+和I2为例,探究该反应是否为可逆反应。
实验方法:在KI溶液中滴加少量FeCl3溶液,将混合溶液均匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉溶液,往试管乙中滴加某溶液,丙试管中加入蒸馏水,如图所示:
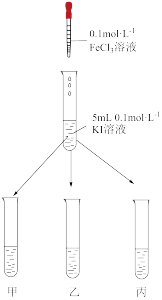
(5)若已知反应为可逆反应,则试管甲中的现象为_______ ,试管乙中加入的试剂为_______ ,现象为_______ 。
【查阅资料】a.Na2S2O3易溶于水,能与硫酸发生反应;
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】


用如图所示装置进行如表所示的 5 个实验,分别测量混合后溶液达到相同浑浊度的过程中, 浑浊度随时间的变化。实验①~⑤所得数据如图曲线①~⑤所示及分组实验数据:

| 实验编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | ||
| c / (mol·L-1) | V / mL | c / (mol·L-1) | V / mL | V / mL | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
(1)实验序号①中,Na2S2O3写出与硫酸的化学反应方程式
(2)实验③中,x =
(3)实验①、②、③的目的是
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对Na2S2O3与硫酸反应的化学反应速率的影响,Na2S2O3溶液浓度的改变影响更大。该推断的证据是
实验二:以Fe3+与I-反应生成Fe2+和I2为例,探究该反应是否为可逆反应。
实验方法:在KI溶液中滴加少量FeCl3溶液,将混合溶液均匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉溶液,往试管乙中滴加某溶液,丙试管中加入蒸馏水,如图所示:

(5)若已知反应为可逆反应,则试管甲中的现象为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


