解答题-原理综合题 适中0.65 引用1 组卷133
C、CO是常见的还原剂,碳与氧气的反应涉及以下三个:
Ⅰ:
Ⅱ:
Ⅲ:
请回答:
(1)
___________  ,
,
___________ (用 表示)。
表示)。
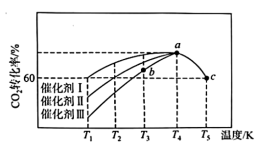
(2)①碳与氧气反应的 与T的关系如下图,反应Ⅱ对应的曲线是
与T的关系如下图,反应Ⅱ对应的曲线是___________ 。
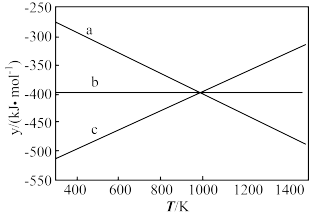
A.a B.b C.c D.无法确定
②下列说法不正确 的是___________ 。
A.熵增有利于反应的进厅,工业生产中可将BaCO3与碳混合煅烧以制取BaO
B.反应的自发性由 共同决定
共同决定
C.随着反应温度的升高,碳被氧化为CO的倾向明显的增强
D.冶金生产中,都可以用碳作还原剂
(3)水煤气反应: ,工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是
,工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是___________ 。
(4)在 作催化剂的条件下合成甲醇:
作催化剂的条件下合成甲醇: ,向恒容密闭容器中通入
,向恒容密闭容器中通入 和
和 ,反应过程中转化率
,反应过程中转化率 与时间
与时间 、温度的关系如下图所示。
、温度的关系如下图所示。
①若初始压强为 下该反应平衡常数
下该反应平衡常数
___________ ( 为以分压表示的平衡常数)
为以分压表示的平衡常数)
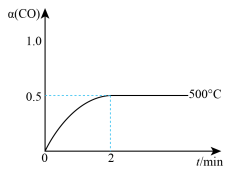
②在500℃恒压条件下,请画出反应体系中a(CO)与时间(t)变化趋势图。______
Ⅰ:
Ⅱ:
Ⅲ:
请回答:
(1)
(2)①碳与氧气反应的

A.a B.b C.c D.无法确定
②下列说法
A.熵增有利于反应的进厅,工业生产中可将BaCO3与碳混合煅烧以制取BaO
B.反应的自发性由
C.随着反应温度的升高,碳被氧化为CO的倾向明显的增强
D.冶金生产中,都可以用碳作还原剂
(3)水煤气反应:
(4)在
①若初始压强为
②在500℃恒压条件下,请画出反应体系中a(CO)与时间(t)变化趋势图。

22-23高二下·浙江衢州·期末
类题推荐
我国提出了碳达峰、碳中和的目标,控制大气中的 浓度,减缓温室效应,将
浓度,减缓温室效应,将 转化为高附加值化工产品成为当前科技工作者的一个重要课题。回答下列问题:
转化为高附加值化工产品成为当前科技工作者的一个重要课题。回答下列问题:

(1)工业生产尿素的基本原料为 ,反应历程中的能量变化如图所示(反应历程中的有关物质均为气态)。写出制备尿素的热化学方程式:
,反应历程中的能量变化如图所示(反应历程中的有关物质均为气态)。写出制备尿素的热化学方程式:_______ 。
利用 和
和 合成甲醇,在催化剂作用下可发生如下两个平行反应:
合成甲醇,在催化剂作用下可发生如下两个平行反应:
反应Ⅰ:
反应Ⅱ:
(2)一定温度下,向恒容密闭容器中充入 和
和 ,在催化剂作用下发生反应,容器内气体压强随时间的变化如表所示。
,在催化剂作用下发生反应,容器内气体压强随时间的变化如表所示。
该温度下,若平衡时 的体积分数为
的体积分数为 ,反应Ⅱ的平衡常数
,反应Ⅱ的平衡常数
_______ ( 为以分压表示的平衡常数,以各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
为以分压表示的平衡常数,以各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
(3)下列说法不正确的是_______。
(4)一定比例的合成气在装有催化剂的反应器中反应 ,体系中甲醇的产率与温度的关系如下图所示,此温度范围内,催化剂活性不受影响。
,体系中甲醇的产率与温度的关系如下图所示,此温度范围内,催化剂活性不受影响。

①当温度高于 后,甲醇产率减小的原因可能是
后,甲醇产率减小的原因可能是_______ 。
②请在图中画出甲醇平衡产率随温度变化的曲线图_______ 。

(1)工业生产尿素的基本原料为
利用
反应Ⅰ:
反应Ⅱ:
(2)一定温度下,向恒容密闭容器中充入
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| 压强 | 320 | 280 | 250 | 226 | 206 | 200 | 200 |
(3)下列说法不正确的是_______。
| A.从反应体系中分离出甲醇,有利于提高反应物的转化率 |
| B.向容器中按原比例再充入反应物,达到新平衡时各组分的体积分数不变 |
| C.当 |
| D.工业合成甲醇时,将气体以一定流速通过催化剂,选择合适催化剂可提高甲醇的平衡产率 |
(4)一定比例的合成气在装有催化剂的反应器中反应

①当温度高于
②请在图中画出甲醇平衡产率随温度变化的曲线图
“碳中和”引起各国的高度重视,正成为科学家研究的热点课题。利用 生产甲醇是资源化利用
生产甲醇是资源化利用 的一种有效途径。涉及的反应如下:
的一种有效途径。涉及的反应如下:
I.

Ⅱ.

Ⅲ.

Ⅳ.

(1)已知反应I和Ⅳ的焓变和熵变如下表所示
你认为哪个反应更适宜于甲醇的工业生产___________ (填“反应I”或“反应Ⅳ”);请应用“化学反应的方向”相关知识说明选择的理由___________ 。
(2)一定温度下,向体积为VL的恒容密闭容器中通入 气体和
气体和 气体发生上述反应,达到平衡时,容器中
气体发生上述反应,达到平衡时,容器中 为
为 ,CO(g)为
,CO(g)为 ,此时,反应Ⅲ的平衡常数为
,此时,反应Ⅲ的平衡常数为___________ (用含a、b的代数式表示;不考虑反应Ⅳ)。
(3)不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示:(已知:
的平衡产率随温度的变化关系如下图所示:(已知: 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率 )
)
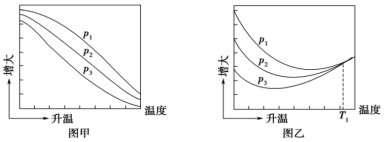
①下列说法正确的是___________ (填字母;不考虑反应Ⅳ)。
A.纵坐标表示 平衡转化率的是图乙
平衡转化率的是图乙
B.压强大小:
C.为同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温低压的反应条件
的平衡产率,应选择低温低压的反应条件
②图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是___________ 。
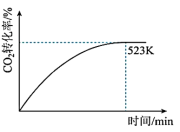
(4)一定条件下,若只按反应Ⅰ进行,温度和时间对 转化率的影响曲线如下图所示。若图中曲线对应的温度为523K,请在下图中作出温度为583K的影响曲线
转化率的影响曲线如下图所示。若图中曲线对应的温度为523K,请在下图中作出温度为583K的影响曲线___________ 。
(5)反应I中,催化剂对 转化率的影响如图所示。则下列说法正确的是___________。
转化率的影响如图所示。则下列说法正确的是___________。
I.
Ⅱ.
Ⅲ.
Ⅳ.
(1)已知反应I和Ⅳ的焓变和熵变如下表所示
| 反应 | ||
| I | ||
| Ⅳ |
你认为哪个反应更适宜于甲醇的工业生产
(2)一定温度下,向体积为VL的恒容密闭容器中通入
(3)不同压强下,按照

①下列说法正确的是
A.纵坐标表示
B.压强大小:
C.为同时提高
②图乙中
(4)一定条件下,若只按反应Ⅰ进行,温度和时间对

(5)反应I中,催化剂对

| A.催化效果最好的是催化剂Ⅲ |
| B.b点一定没有达到平衡 |
| C.c点处的反应速率为: |
| D.a点后 |
“一碳化学”是指以研究分子中只含有一个碳原子的化合物(如CO、CO2、CH3OH等)为原料合成一系列化工产品的化学。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
反应CO(g)+2H2(g) CH3OH(g)的ΔH=
CH3OH(g)的ΔH=_____ kJ·mol-1。
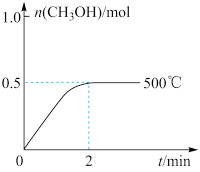
(2)向2L恒容密闭容器中通入1 mol CO(g)和2 mol H2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图________ 。
(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:
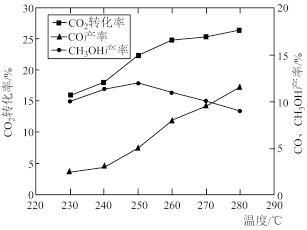
①由图可知温度升高CO产率上升,其主要原因是_____ 。
②由图可知获取甲醇最适宜的温度是_____ 。
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0 L,若CO2初始加入量为2.0 mol,则反应Ⅰ的平衡常数是_____ 。
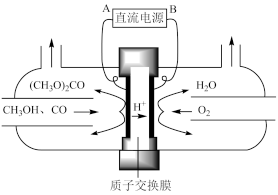
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2 2(CH3O)2CO+2H2O
2(CH3O)2CO+2H2O
(5)由图可知B极为电源_________ (填“正”或“负”)极,阳极电极反应式是________ 。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
| 物质 | H2(g) | CO(g) | CH3OH(l) |
| 燃烧热/kJ·mol-1 | -285.8 | -283.0 | -726.5 |
(2)向2L恒容密闭容器中通入1 mol CO(g)和2 mol H2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图

(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应Ⅰ:CO2(g)+3H2(g)
反应Ⅱ:CO2(g)+H2(g)
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:

①由图可知温度升高CO产率上升,其主要原因是
②由图可知获取甲醇最适宜的温度是
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0 L,若CO2初始加入量为2.0 mol,则反应Ⅰ的平衡常数是
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2
(5)由图可知B极为电源

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


