解答题-原理综合题 适中0.65 引用1 组卷101
广泛使用的消毒剂
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
(2)化学电池应用广泛,某电池企业通过回收废旧电池生产消毒液。
①如图Cu-Zn原电池中,导线中电子流向___________ 片(填 “Zn”或“Cu”)。Cu片上发生___________ 反应(填 “氧化”或“还原”)。
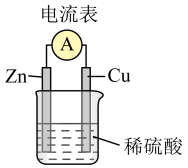
②若将铜片换成铁片,电流方向___________ 改变(填 “会”或“不会”)。
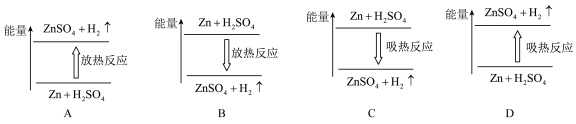
(3)若断开电路,则该反应中能量变化示意图正确的是___________ 。
Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3 3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
(4)30°C、pH=5.0时,O3的平均反应速率为___________ 。
(5)若反应达平衡后降温,则平衡向___________ 移动,正反应速率___________ (填“增大”“减小”或“不变”)。
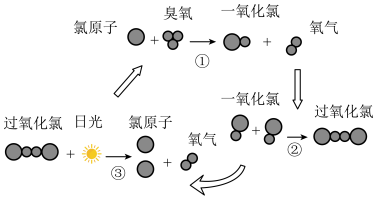
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________
(7)一些含硫物质也能做消毒剂。硫位于元素周期表中第___________ 周期,第___________ 族。用一个化学事实比较Cl和S的非金属性强弱___________ 。
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
| A.电离方程式:NaClO=Na+ + Cl- + O2- |
| B.和稀盐酸反应的产物无漂白性 |
| C.属于强电解质 |
| D.具有强氧化性 |
①如图Cu-Zn原电池中,导线中电子流向

②若将铜片换成铁片,电流方向
(3)若断开电路,则该反应中能量变化示意图正确的是

Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 |
| 20 | 301 | 231 | 169 |
| 30 | 158 | 108 | 54 |
| 50 | 35 | 26 | 15 |
(5)若反应达平衡后降温,则平衡向
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________

| A.反应中Cl作催化剂 |
| B.过氧化氯的分子式为:Cl2O2 |
| C.过氧化氯的结构式为:O-Cl-Cl-O |
| D.该过程中能量转化形式只有一种 |
22-23高二下·上海杨浦·期末
类题推荐
研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因_________ 。已知春季海水pH=8.1,预测夏季海水碱性将会_________ (填写“增强”或“减弱”),理由是________ (写出1条即可)
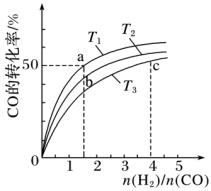
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________ (a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
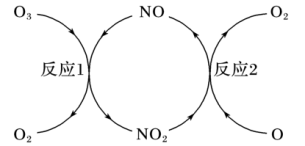
①NO的作用是__________________ 。
②已知:O3(g)+O(g)=2O2(g)△H =-143kJ·mol-1
反应1: O3(g)+NO(g) NO2(g)+O2(g)△H1=-200.2kJ·mol-1
NO2(g)+O2(g)△H1=-200.2kJ·mol-1
反应2:热化学方程式为______________________ 。
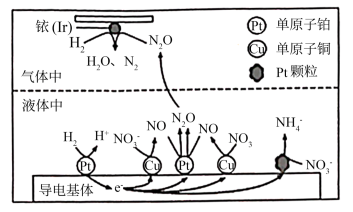
(4)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为__________________________ 。
②若导电基体上的Pt颗粒增多,造成的后果是__________________________ 。
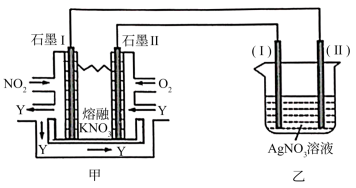
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为__________________________ 。
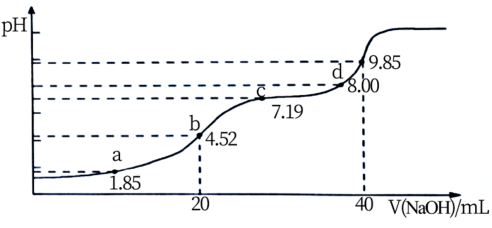
(6)大气污染物SO2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是__________________________ ;c点所得溶液中:c(Na+)__________ 3c(HSO3-)(填“>”、“<”或“=”)
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因
| 无机碳 | HCO3- | 90% |
| CO32- | 9% | |
| CO2 | 1% | |
| H2CO3 | ||
| 其中H2CO3仅为CO2的0.2% | ||

(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:

①NO的作用是
②已知:O3(g)+O(g)=2O2(g)△H =-143kJ·mol-1
反应1: O3(g)+NO(g)
 NO2(g)+O2(g)△H1=-200.2kJ·mol-1
NO2(g)+O2(g)△H1=-200.2kJ·mol-1反应2:热化学方程式为
(4)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为
②若导电基体上的Pt颗粒增多,造成的后果是


(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为
(6)大气污染物SO2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 COCl2(g)。 在1 L恒温恒容密闭容器中充入2.5 mol CO和1.5 mol Cl2,在催化剂作用下发生反应,测得CO及COCl2的物质的量随时间变化如图所示:
COCl2(g)。 在1 L恒温恒容密闭容器中充入2.5 mol CO和1.5 mol Cl2,在催化剂作用下发生反应,测得CO及COCl2的物质的量随时间变化如图所示:



