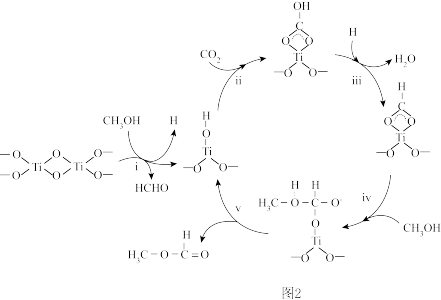
解答题-原理综合题 较难0.4 引用1 组卷146
我国科学家利用Fe2Na3红紫素催化剂实现CO2还原制备CO,利用可见光催化还原CO2,将CO2转化为增值化学原料(HCOOH、HCHO、CH3OH等),这被认为是一种可持续的CO2资源化有效途径。
(1)已知几种物质的燃烧热(△H)如表所示:
已知:H2O(g)=H2O(l) △H=—44kJ•mol-1,CO2(g)+2H2(g) HCHO(g)+H2O(g) △H=
HCHO(g)+H2O(g) △H=_______ kJ•mol-1。
(2)在一定温度下,将1molCO2(g)和3molH2(g)通入某恒容密闭容器中,发生反应CO2(g)+H2(g) HCOOH(g),测得不同时刻容器中CO2的体积分数[φ(CO2)]如表所示:
HCOOH(g),测得不同时刻容器中CO2的体积分数[φ(CO2)]如表所示:
达到平衡时CO2的转化率为________ 。
(3)将n(CO2):n(H2)=1:4的混合气体充入某密闭容器中,同时发生反应1和反应2。
反应1:CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.2kJ•mol-1
CO(g)+H2O(g) △H1=+41.2kJ•mol-1
反应2:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2<0。
CH3OH(g)+H2O(g) △H2<0。
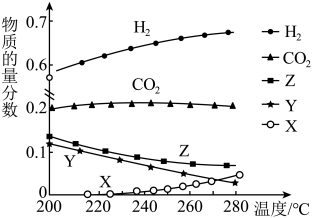
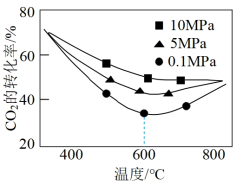
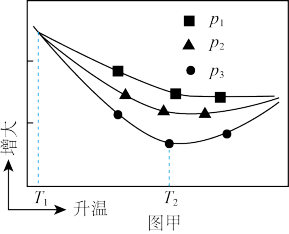
在不同温度、压强下,测得相同时间内CO2的转化率如图,0.1MPa时,CO2的转化率在600℃之后随温度升高而增大的主要原因是________ 。
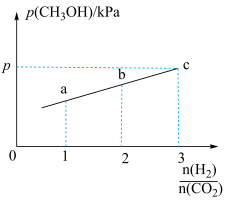
(4)在一定温度下,向容积为2L的恒容密闭容器中充入1molCO2(g)和nmolH2(g),仅发生(3)中的反应2。实验测得CH3OH的平衡分压与起始投料比[ ]的关系如图:
]的关系如图:
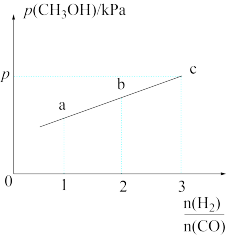
①起始时容器内气体的总压强为8pkPa,若10min时反应到达c点,则0~10min内,v(H2)=________ mol•L-1•min-1。
②b点时反应的平衡常数Kp=_______ (用含p的表达式表示)(kPa)-2。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)
(5)我国科学家开发催化剂,以惰性材料为阳极,在酸性条件下电解还原CO2制备HCHO,其阴极的电极反应式为________ 。
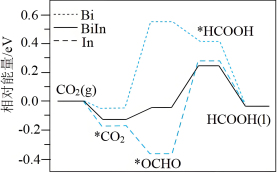
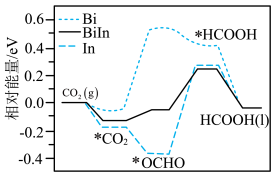
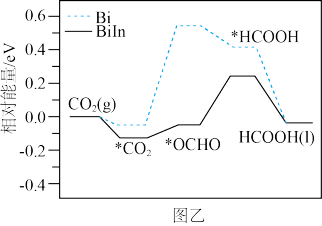
(6)我国学者探究了Biln合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用Biln合金催化剂优于单金属Bi催化剂的原因:________ 。
(1)已知几种物质的燃烧热(△H)如表所示:
| 物质 | HCHO(g) | H2(g) |
| 燃烧热(△H)/(kJ•mol-1) | -570.8 | -285.8 |
(2)在一定温度下,将1molCO2(g)和3molH2(g)通入某恒容密闭容器中,发生反应CO2(g)+H2(g)
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO2) | 0.250 | 0.230 | 0.215 | 0.205 | 0.200 | 0.200 |
(3)将n(CO2):n(H2)=1:4的混合气体充入某密闭容器中,同时发生反应1和反应2。
反应1:CO2(g)+H2(g)
反应2:CO2(g)+3H2(g)
在不同温度、压强下,测得相同时间内CO2的转化率如图,0.1MPa时,CO2的转化率在600℃之后随温度升高而增大的主要原因是

(4)在一定温度下,向容积为2L的恒容密闭容器中充入1molCO2(g)和nmolH2(g),仅发生(3)中的反应2。实验测得CH3OH的平衡分压与起始投料比[

①起始时容器内气体的总压强为8pkPa,若10min时反应到达c点,则0~10min内,v(H2)=
②b点时反应的平衡常数Kp=
(5)我国科学家开发催化剂,以惰性材料为阳极,在酸性条件下电解还原CO2制备HCHO,其阴极的电极反应式为
(6)我国学者探究了Biln合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用Biln合金催化剂优于单金属Bi催化剂的原因:

2022·广东·模拟预测
类题推荐
利用可见光催化还原 ,将
,将 转化为增值化学原料(HCOOH、HCHO、
转化为增值化学原料(HCOOH、HCHO、 等),被认为是一种可持续的
等),被认为是一种可持续的 资源化有效途径。
资源化有效途径。
(1)已知:







___________  。
。
(2)在一定温度下,将1mol 和3mol
和3mol 通入某恒容密闭容器中,发生反应
通入某恒容密闭容器中,发生反应 ,测得不同时刻容器中
,测得不同时刻容器中 的体积分数
的体积分数 如表所示。
如表所示。
达到平衡时 的转化率为
的转化率为___________ 。
(3)将 的混合气体充入某密闭容器中,同时发生反应Ⅰ和反应Ⅱ。
的混合气体充入某密闭容器中,同时发生反应Ⅰ和反应Ⅱ。
反应Ⅰ:
 。
。
反应Ⅱ:
 。
。
在相同时间内,测得 的平衡转化率随温度、压强的变化关系如图甲。
的平衡转化率随温度、压强的变化关系如图甲。 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ;温度从 到
到 ,
, 转化率变化的主要原因是
转化率变化的主要原因是___________ 。
②在一定温度下,向容积为2L的恒容密闭容器中充入1mol 和3mol
和3mol ,仅发生反应Ⅱ。起始时容器内气体的总压强为8pkPa,若10min时实验测得
,仅发生反应Ⅱ。起始时容器内气体的总压强为8pkPa,若10min时实验测得 的平衡分压为pkPa,则0~10min内,
的平衡分压为pkPa,则0~10min内,
___________  ,该反应的
,该反应的
___________ 。
(4)Bi与BiIn合金催化剂电化学还原 生产HCOOH的催化机理及在催化剂表面还原过程各物质的相对能量变化,如图乙所示(带“*”表示物质处于吸附态)。
生产HCOOH的催化机理及在催化剂表面还原过程各物质的相对能量变化,如图乙所示(带“*”表示物质处于吸附态)。
① 转化为*OCHO效果更好的催化剂
转化为*OCHO效果更好的催化剂___________ 。
②*OCHO转化为HCOOH能垒较大的催化剂___________ 。
(1)已知:
(2)在一定温度下,将1mol
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.215 | 0.205 | 0.200 | 0.200 |
(3)将
反应Ⅰ:
反应Ⅱ:
在相同时间内,测得
②在一定温度下,向容积为2L的恒容密闭容器中充入1mol
(4)Bi与BiIn合金催化剂电化学还原
①
②*OCHO转化为HCOOH能垒较大的催化剂
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网