解答题-原理综合题 较难0.4 引用1 组卷109
环戊烯(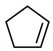 )常用于有机合成及树脂交联等。在催化剂的作用下,可通过环戊二烯(
)常用于有机合成及树脂交联等。在催化剂的作用下,可通过环戊二烯(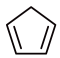 )选择性氢化制得,体系中同时存在如下反应:.
)选择性氢化制得,体系中同时存在如下反应:.
反应I: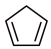 (g)+H2(g)
(g)+H2(g)
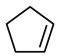 (g) ΔH1=-100.3kJ•mol-1
(g) ΔH1=-100.3kJ•mol-1
反应II: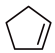 (g)+H2(g)
(g)+H2(g)
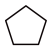 (g) ΔH2=-109.4kJ•mol-1
(g) ΔH2=-109.4kJ•mol-1
反应III: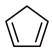 (g)+
(g)+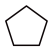 (g)
(g) 2
2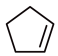 (g) ΔH3
(g) ΔH3
已知:选择性是指生成目标产物所消耗的原料量在全部所消耗原料量中所占的比例。回答下列问题:
(1)反应III的ΔH3=_______ kJ•mol-1。
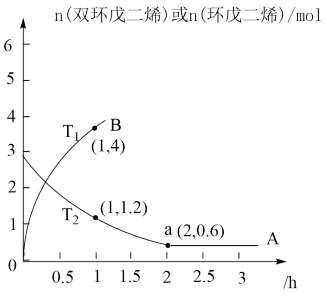
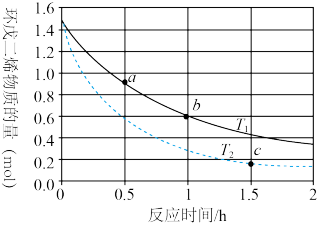
(2)为研究上述平衡关系,在T℃下,向密闭容器中加入amol环戊二烯和4molH2,测得平衡时,容器中环戊二烯、环戊烯、环戊烷的物质的量之比为1:4:1,则环戊烯的选择性为_______ ,反应I以物质的量分数表示的平衡常数Kxi为_______ 。
(3)实际生产中采用双环戊二烯(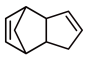 )解聚成环戊二烯(
)解聚成环戊二烯(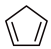 ):
):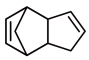 (双环戊二烯)(g)
(双环戊二烯)(g) 2
2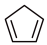 (g) ΔH>0。
(g) ΔH>0。
①解聚反应和二聚反应的活化能:Ea(解聚)_______ Ea(二聚)(填“<”“>”或“=”)。
②将环戊二烯溶于有机溶剂中可提高解聚反应的程度,原因是_______ 。
③实际生产中常通入氮气以解决解聚问题(氮气不参与反应)。某温度下,向恒容密闭容器中通入总压为100kPa的双环戊二烯和氮气,达到平衡后总压为160kPa,双环戊二烯的转化率为80%,则p(N2)=________ kPa,平衡常数Kp=_______ kPa。[已知Kp= ]
]
 )常用于有机合成及树脂交联等。在催化剂的作用下,可通过环戊二烯(
)常用于有机合成及树脂交联等。在催化剂的作用下,可通过环戊二烯( )选择性氢化制得,体系中同时存在如下反应:.
)选择性氢化制得,体系中同时存在如下反应:.反应I:
 (g)+H2(g)
(g)+H2(g) (g) ΔH1=-100.3kJ•mol-1
(g) ΔH1=-100.3kJ•mol-1反应II:
 (g)+H2(g)
(g)+H2(g) (g) ΔH2=-109.4kJ•mol-1
(g) ΔH2=-109.4kJ•mol-1反应III:
 (g)+
(g)+ (g)
(g) (g) ΔH3
(g) ΔH3已知:选择性是指生成目标产物所消耗的原料量在全部所消耗原料量中所占的比例。回答下列问题:
(1)反应III的ΔH3=
(2)为研究上述平衡关系,在T℃下,向密闭容器中加入amol环戊二烯和4molH2,测得平衡时,容器中环戊二烯、环戊烯、环戊烷的物质的量之比为1:4:1,则环戊烯的选择性为
(3)实际生产中采用双环戊二烯(
 )解聚成环戊二烯(
)解聚成环戊二烯( ):
): (双环戊二烯)(g)
(双环戊二烯)(g) (g) ΔH>0。
(g) ΔH>0。①解聚反应和二聚反应的活化能:Ea(解聚)
②将环戊二烯溶于有机溶剂中可提高解聚反应的程度,原因是
③实际生产中常通入氮气以解决解聚问题(氮气不参与反应)。某温度下,向恒容密闭容器中通入总压为100kPa的双环戊二烯和氮气,达到平衡后总压为160kPa,双环戊二烯的转化率为80%,则p(N2)=
2023·河南郑州·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
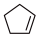 )常用于有机合成及树脂交联等。在催化剂作用下,可通过环戊二烯(
)常用于有机合成及树脂交联等。在催化剂作用下,可通过环戊二烯(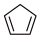 ) 选择性氧化制得,体系中同时存在如下反应:
) 选择性氧化制得,体系中同时存在如下反应: (g)+H2(g)
(g)+H2(g)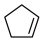 (g) ΔH1=-100.3kJ/mol
(g) ΔH1=-100.3kJ/mol (g)+H2(g)
(g)+H2(g)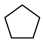 (g) ΔH2=-109.4kJ/mol
(g) ΔH2=-109.4kJ/mol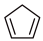 (g)+
(g)+ (g)
(g) (g) ΔH3
(g) ΔH3 )的物质的量相等,环戊烯的选择性为 80%,此时H2的转化率为
)的物质的量相等,环戊烯的选择性为 80%,此时H2的转化率为
 )解聚成环戊二烯:
)解聚成环戊二烯: (g)
(g)
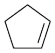 )常用于有机合成及树脂交联等。在催化剂作用下,可通过环戊二烯(
)常用于有机合成及树脂交联等。在催化剂作用下,可通过环戊二烯(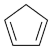 )选择性氧化制得,体系中同时存在如下反应:
)选择性氧化制得,体系中同时存在如下反应: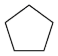 (g)
(g)
 )解聚成环戊二烯:
)解聚成环戊二烯: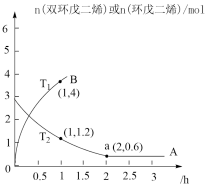
 )常用于有机合成及树脂交联等。在催化剂作用下,可由环戊二烯(
)常用于有机合成及树脂交联等。在催化剂作用下,可由环戊二烯( )选择性氢化制得,体系中同时存在如下反应:
)选择性氢化制得,体系中同时存在如下反应: (g)+H2(g)
(g)+H2(g)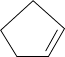 (g)
(g) (g) +H2(g)
(g) +H2(g)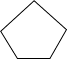 (g)
(g) (g)+
(g)+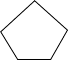 (g)
(g)  (g)
(g) )的物质的量相等,环戊烯的选择性为80%,此时
)的物质的量相等,环戊烯的选择性为80%,此时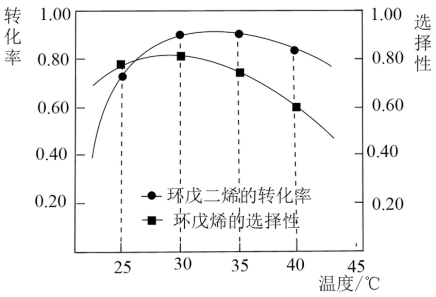
 )解聚成环戊二烯:
)解聚成环戊二烯: (g)
(g)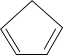 (g)
(g)