解答题-结构与性质 较难0.4 引用1 组卷345
近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料( Bi - MOF),反应可简单表示为Bi( NO3)3·5H2O + BTC Bi – MOF。回答下列问题:
Bi – MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为___________ 。
Bi(NO3)3中阴离子的立体构型为___________ 。基态O原子核外成对电子数与未成对电子数之比为___________ 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为___________ 。C2H5OH的沸点高于CH3OCH3,原因是___________ 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
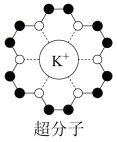
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为___________ 。
②下列叙述正确的是___________ (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
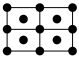
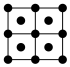
(4)铋的相关晶胞如图所示。
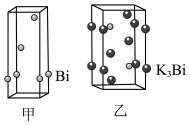
①等晶胞数的甲、乙中含铋原子数之比为___________ 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度___________ g·cm-3(只列计算式)。
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为
Bi(NO3)3中阴离子的立体构型为
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。

已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为
②下列叙述正确的是
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。

①等晶胞数的甲、乙中含铋原子数之比为
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度
2023·河南·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网