解答题-实验探究题 适中0.65 引用1 组卷66
化学研究和工业生产中需要关注化学反应的快慢和程度。速率与限度是认识和研究化学反应的重要视角。
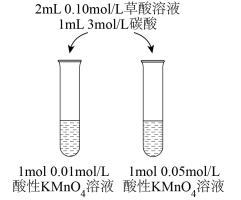
(1)某同学对草酸溶液与酸性高锰酸钾溶液的反应速率影响因素进行研究。该同学采用如图所示的实验方案,拟根据溶液褪色的先后顺序定性探究外界条件对反应速率的影响。
①该同学拟研究的影响因素是_______ 。
②你认为该同学的实验方案_______ (填“合理”或“不合理”),理由是_______ 。
(2)亚硝酰氯 是有机合成中常用试剂,已知:
是有机合成中常用试剂,已知:
 。在体积为
。在体积为 恒容密闭容器中充入
恒容密闭容器中充入
 和
和
 ,在不同温度下发生反应,
,在不同温度下发生反应, 的百分含量随时间的变化如图所示。(已知:
的百分含量随时间的变化如图所示。(已知: )
)
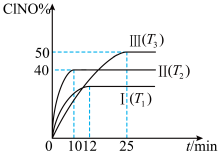
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是_______ 。
②实验Ⅱ反应至 达到平衡,此时
达到平衡,此时 的转化率为
的转化率为_______ (保留1位小数)。
③实验Ⅲ反应至 达到平衡,则
达到平衡,则
_______  。
。

(1)某同学对草酸溶液与酸性高锰酸钾溶液的反应速率影响因素进行研究。该同学采用如图所示的实验方案,拟根据溶液褪色的先后顺序定性探究外界条件对反应速率的影响。
①该同学拟研究的影响因素是
②你认为该同学的实验方案
(2)亚硝酰氯

①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是
②实验Ⅱ反应至
③实验Ⅲ反应至
22-23高一下·辽宁营口·期中
类题推荐
反应条件的选择是工业生产的重点课题,既要有适当的反应速率,又要有适当的转化效率(即反应限度)。
(1)某实验小组在实验室模拟工业合成氨。在5L恒温恒容密闭容器中充入1.95molH2和0.65molN2,反应一段时间后容器中NH3的浓度变化如图所示。
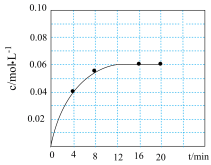
①已知N2的沸点为-195℃、O2的沸点为-183℃,则从液态空气中分离获得原料N2时,从液态空气中先汽化的是______ (填“N2”或“O2”)。
②0~12min内,用H2表示的化学反应速率v(H2)=______ 。
③该温度下,达到平衡状态时, =
=______ L2•mol-2(结果保留三位有效数字)。
(2)该实验小组为探究外界条件对化学反应速率的影响进行如下实验。
i.探究常温下等质量金属与酸反应生成氢气速率的影响因素,进行如表实验:
①实验Ⅰ中没发现生成氢气是因为______ 。由实验Ⅱ、Ⅲ可以得到的结论是______ 。由实验Ⅱ、Ⅳ可以得到的结论是______ 。
②甲同学在进行实验Ⅳ时又加入了少量硫酸铜固体,意外发现生成气体速率明显加快,试分析其原因:______ 。
ii.已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表所示(所取溶液体积均为2mL)。
③由表中数据可知,反应速率由大到小的顺序为______ (用编号表示)。
(1)某实验小组在实验室模拟工业合成氨。在5L恒温恒容密闭容器中充入1.95molH2和0.65molN2,反应一段时间后容器中NH3的浓度变化如图所示。

①已知N2的沸点为-195℃、O2的沸点为-183℃,则从液态空气中分离获得原料N2时,从液态空气中先汽化的是
②0~12min内,用H2表示的化学反应速率v(H2)=
③该温度下,达到平衡状态时,
(2)该实验小组为探究外界条件对化学反应速率的影响进行如下实验。
i.探究常温下等质量金属与酸反应生成氢气速率的影响因素,进行如表实验:
| 实验编号 | 金属 | c(酸)/(mol•L-1) | 溶液体积/mL |
| Ⅰ | 铁块 | 18.4mol•L-1硫酸 | 10 |
| Ⅱ | 铁粉 | 2mol•L-1硫酸 | 10 |
| Ⅲ | 铁粉 | 2mol•L-1盐酸 | 20 |
| Ⅳ | 铁块 | 2mol•L-1硫酸 | 10 |
①实验Ⅰ中没发现生成氢气是因为
②甲同学在进行实验Ⅳ时又加入了少量硫酸铜固体,意外发现生成气体速率明显加快,试分析其原因:
ii.已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如表所示(所取溶液体积均为2mL)。
| 实验编号 | 温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| a | 25 | 0.1 | 0.1 |
| b | 25 | 0.2 | 0.1 |
| c | 50 | 0.2 | 0.1 |
③由表中数据可知,反应速率由大到小的顺序为
某化学兴趣小组学习了化学反应的限度和速率后,对化学反应的机理及外界条件的改变对化学反应速率和化学平衡的影响进行探究。
I.探究化学反应机理
该小组同学在研究中发现 的反应速率随温度的升高而减小,为探究这一反常现象,查阅资料后得知该反应的反应历程分为两步:
的反应速率随温度的升高而减小,为探究这一反常现象,查阅资料后得知该反应的反应历程分为两步:
①
 (快反应)
(快反应)  ,
, ;②
;②
 (慢反应)
(慢反应)  ,
, 。
。
(1)反应①、②的活化能的大小关系为
______ (填“>”“<”或“=”) ;反应②的化学平衡常数
;反应②的化学平衡常数
______ [用 、
、 表示]。
表示]。
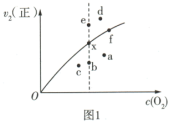
(2)对实验数据分析得到 的浓度和
的浓度和 (正)的关系如图1所示,当升高到某一温度,反应重新达到平衡时x点变为的点是
(正)的关系如图1所示,当升高到某一温度,反应重新达到平衡时x点变为的点是______ (填对应点的字母)。
II.探究外界条件的改变对化学反应速率和化学平衡的影响
(3)以
 为例,研究外界条件的改变对化学反应速率和化学平衡的影响。
为例,研究外界条件的改变对化学反应速率和化学平衡的影响。
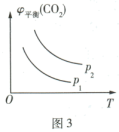
①在体积不变的密闭容器中分别充入等量CO和NO进行反应,改变外界条件,实验测得CO的物质的量随时间的变化曲线如图2所示。(已知当催化剂的质量相同时,催化剂的比表面积越大,化学反应速率越快)

实验1、2、3代表的实验编号分别是______ (按顺序填写实验编号)。
②如图3表示上述反应中 的平衡体积分数
的平衡体积分数 随压强、温度的变化,则
随压强、温度的变化,则 、
、 的关系是
的关系是
______ (填“>”“<”或“=”,下同) ,Q
,Q______ 0。
I.探究化学反应机理
该小组同学在研究中发现
①
(1)反应①、②的活化能的大小关系为
(2)对实验数据分析得到

II.探究外界条件的改变对化学反应速率和化学平衡的影响
(3)以
①在体积不变的密闭容器中分别充入等量CO和NO进行反应,改变外界条件,实验测得CO的物质的量随时间的变化曲线如图2所示。(已知当催化剂的质量相同时,催化剂的比表面积越大,化学反应速率越快)

实验1、2、3代表的实验编号分别是
实验编号 | 温度/℃ | 催化剂的比表面积/( | 催化剂的用量/g |
A | 280 | 41 | 25 |
B | 280 | 62 | 25 |
C | 350 | 62 | 25 |

研究化学反应的原理,对掌握物质的应用有重要的意义。硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如图所示:_____ (选填“吸热”或“放热”)反应。 变成
变成 ,放出
,放出_____  的热量。
的热量。
(2)氢氧燃料电池具有清洁高效等优点,简易装置如图所示。该电池的负极为_____ (选填“a”或“b”),电池的正极反应为_____ 。
实验原理:
①探究实验中,提供 的酸是
的酸是_____ (填化学式)。
②实验3中,
_____ 。
③根据上表中的实验数据,可以得到的结论是_____ 。
④利用实验1中数据计算,用 的浓度变化表示的平均反应速率:
的浓度变化表示的平均反应速率:
_____  。
。
(4)在催化转化器中,汽车尾气中的 和
和 可发生反应
可发生反应 ,若在容积为10L的密闭容器中进行该反应,起始时充入
,若在容积为10L的密闭容器中进行该反应,起始时充入 ,
, ,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。 从开始至平衡时的反应速率
从开始至平衡时的反应速率
_____ ;达平衡时各物质浓度关系式:
_____ (保留3位有效数字)。
②实验a中平衡时NO的物质的量为_____  。
。
③与实验 相比,实验
相比,实验 改变的条件是
改变的条件是_____ 。

(2)氢氧燃料电池具有清洁高效等优点,简易装置如图所示。该电池的负极为

实验原理:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液颜色褪至无色所需时间 | |||
| 0.6mol/L | 0.2mol/L | ||||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | V | 1.0 | 2.0 | 6.4 |
②实验3中,
③根据上表中的实验数据,可以得到的结论是
④利用实验1中数据计算,用
(4)在催化转化器中,汽车尾气中的

②实验a中平衡时NO的物质的量为
③与实验
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


