解答题-原理综合题 适中0.65 引用1 组卷48
在一定温度下,向一容积为5L的恒容密闭容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H=-196 kJ∙mol-1;经5min后达到平衡,此时容器内压强与起始压强之比为0.7,请回答下列问题:
2SO3(g) ∆H=-196 kJ∙mol-1;经5min后达到平衡,此时容器内压强与起始压强之比为0.7,请回答下列问题:
(1)判断该反应达到平衡状态的标志是_______(填字母)。
(2)从反应开始到平衡的这段时间,SO2的平均反应速率v(SO2)=_______ mol·L-1·min-1。
(3)达平衡时SO2的转化率为_______ ,达到平衡时反应放出的热量为_______ kJ。
(4)从理论上分析,为了使二氧化硫尽可能多的转化为三氧化硫,应选择的条件是_______ (填“低温高压”“低温低压”“高温高压”或“高温低压”)。实际生产时选用温度400~500℃,压强采用常压的原因是_______ 。
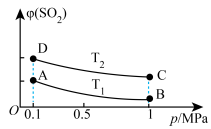
(5)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。
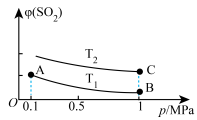
则温度关系:T1_______ T2(填“>”“<”或“=”),A、B、C三点的化学平衡常数的关系是_______ 。
(1)判断该反应达到平衡状态的标志是_______(填字母)。
| A.SO2的物质的量不再变化 |
| B.容器内混合气体的密度保持不变 |
| C.SO2的生成速率和SO3的生成速率相等 |
| D.SO2、O2、SO3三者的浓度之比为 |
(3)达平衡时SO2的转化率为
(4)从理论上分析,为了使二氧化硫尽可能多的转化为三氧化硫,应选择的条件是
(5)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。

则温度关系:T1
22-23高二下·安徽安庆·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网