解答题-原理综合题 较难0.4 引用1 组卷175
氯及其化合物在生产、生活中广泛应用。
(1)三氯乙醛常用于制造农药。化学反应原理是4Cl2(g)+C2H5OH(g) CCl3CHO(g)+5HCl(g)。一定温度下,在某恒容密闭容器中充入4molCl2和2molC2H5OH(g),发生上述反应。下列叙述正确的是_____
CCl3CHO(g)+5HCl(g)。一定温度下,在某恒容密闭容器中充入4molCl2和2molC2H5OH(g),发生上述反应。下列叙述正确的是_____
(2)SCl4是一种化工产品。已知有关反应如下:
①2S(1)+Cl2(g)=S2Cl2(1) ΔH1=akJ·mol-1
②S2C12(1)+Cl2(g)=2SCl2(1) ΔH2=bkJ·mol-1
③SC12(1)+Cl2(g)=SCl4(1) ΔH3=ckJ·mol-1
④S(1)+2Cl2(g)=SCl4(l) ΔH4=_____ kJ·mol-1(用含a、b和c的式子表示)。
(3)工业上,曾用催化氧化氯化氢法(俗称地康法)制备氯气:
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH
2Cl2(g)+2H2O(g) ΔH
从化学反应原理角度分析,一定条件下,投料比 是提高HCl平衡转化率和反应速率以及提纯氯气的关键条件。若投料比太小,有利的是
是提高HCl平衡转化率和反应速率以及提纯氯气的关键条件。若投料比太小,有利的是_____ ;不利的是_____ 。
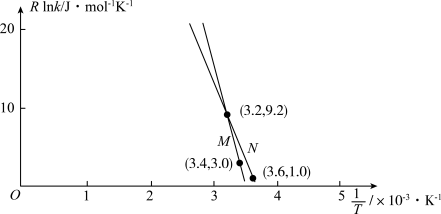
(4)已知Arrhenius经验公式为Rlnk=- +C(Ea为活化能,k为速率常数,R和C为常数,活化能不随温度变化)。为了探究催化剂对地康法制氯气的影响,某小组选择ZnCl2、CuCl2为催化剂,探究其对氯化氢催化氧化反应的影响,实验结果如图1所示。
+C(Ea为活化能,k为速率常数,R和C为常数,活化能不随温度变化)。为了探究催化剂对地康法制氯气的影响,某小组选择ZnCl2、CuCl2为催化剂,探究其对氯化氢催化氧化反应的影响,实验结果如图1所示。
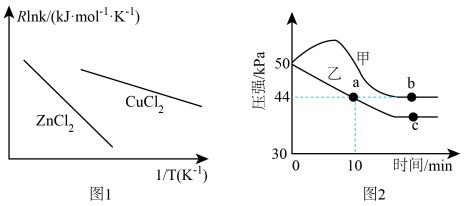
从图1中信息获知催化效能较低的催化剂是_____ (填化学式),其理由是_____ 。
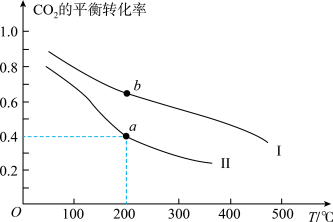
(5)在体积相同的甲、乙两个密闭容器中充入4molHCl(g)和1molO2(g),分别在恒容恒温、恒容绝热条件下发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)ΔH,测得气体压强变化与时间关系如图2所示。
2Cl2(g)+2H2O(g)ΔH,测得气体压强变化与时间关系如图2所示。
①气体总物质的量:n(a)______ n(b)(填“>”“<”或“=”,下同)。
②a点Qp= =
=_____ (kPa)-1(结果保留2位小数)。b点Kp_____ a点Qp。
(1)三氯乙醛常用于制造农药。化学反应原理是4Cl2(g)+C2H5OH(g)
| A.混合气体平均摩尔质量不变时达到平衡状态 |
| B.平衡后再充入少量Cl2反应正向进行 |
| C.加入高效催化剂,能提高氯气的平衡产率 |
| D.平衡时三氯乙醛体积分数可能等于15% |
①2S(1)+Cl2(g)=S2Cl2(1) ΔH1=akJ·mol-1
②S2C12(1)+Cl2(g)=2SCl2(1) ΔH2=bkJ·mol-1
③SC12(1)+Cl2(g)=SCl4(1) ΔH3=ckJ·mol-1
④S(1)+2Cl2(g)=SCl4(l) ΔH4=
(3)工业上,曾用催化氧化氯化氢法(俗称地康法)制备氯气:
4HCl(g)+O2(g)
从化学反应原理角度分析,一定条件下,投料比
(4)已知Arrhenius经验公式为Rlnk=-

从图1中信息获知催化效能较低的催化剂是
(5)在体积相同的甲、乙两个密闭容器中充入4molHCl(g)和1molO2(g),分别在恒容恒温、恒容绝热条件下发生反应:4HCl(g)+O2(g)
①气体总物质的量:n(a)_
②a点Qp=
2023·河南·模拟预测
类题推荐
将玉米秸秆进行热化学裂解可制备出以CO、CO2、H2、N2为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
(1)已知:几种常见共价键的键能如表所示。
由此可估算反应CO(g)+2H2(g) CH3OH(g)的焓变△H=
CH3OH(g)的焓变△H=____ kJ·mol-1。
(2)若在恒温恒容的密闭容器中按n(CO):n(H2)=1:2投料进行上述反应,下列说法正确的是____ (填标号)。
(3)H2和CO2合成乙醇的反应为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。将等物质的量的H2和CO2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的变化关系如图所示。
C2H5OH(g)+3H2O(g)。将等物质的量的H2和CO2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的变化关系如图所示。
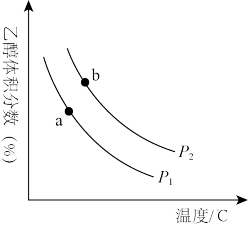
①a、b两点的平衡常数Ka_____ Kb(填“>”“<”或“=”)。判断依据是____ 。
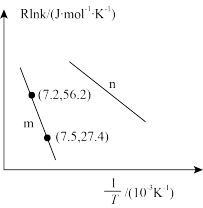
②已知Arrhenius经验公式为Rlnk=- +C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得如图所示曲线。在m催化剂作用下,该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得如图所示曲线。在m催化剂作用下,该反应的活化能Ea=____ kJ·mol-1。
(1)已知:几种常见共价键的键能如表所示。
| 共价键 | C-H | C-O | C≡O | H-H | O-H |
| 键能(kJ·mol-1) | 410 | 358 | 839 | 436 | 467 |
(2)若在恒温恒容的密闭容器中按n(CO):n(H2)=1:2投料进行上述反应,下列说法正确的是
| A.体系压强不再发生变化时,反应达到化学平衡状态 |
| B.平衡体系中,H2和CO的物质的量之比为1∶2 |
| C.平衡后投入适量的CH3OH,一段时间后再次平衡,CH3OH的体积分数与原平衡相比增大 |
| D.其他条件不变,增大CO的浓度,能提高CO的平衡转化率 |

①a、b两点的平衡常数Ka
②已知Arrhenius经验公式为Rlnk=-

丙烯是制备聚丙烯的单体,在催化剂作用下,可由丙烷直接脱氢制得。
已知:反应I: C3H8(g) C3H6(g)+H2(g) ΔH1 = +124. 3kJ·mol-1;
C3H6(g)+H2(g) ΔH1 = +124. 3kJ·mol-1;
反应II: H2O(g) H2(g)+
H2(g)+  O2(g) ΔH2= +242kJ·mol-1;
O2(g) ΔH2= +242kJ·mol-1;
(1)丙烷可氧化直接脱氢发生反应III 2C3H8(g) +O2(g) 2C3H6(g)+2H2O(g) ΔH3=
2C3H6(g)+2H2O(g) ΔH3=___________ kJ·mol-1,该反应能自发进行的条件是在___________ (填“低温”、“高温”或“任意温度”)下。
(2)向某绝热恒容密闭容器内充入一定量的C3H8和O2,发生反应III.下列能说明该反应达到平衡状态的是___________ (填标号)。
(3)对于反应III,v正=k正·p2(C3H8)·p2(O2),v逆=k逆·p2(C3H6)·p2(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在TK下,按初始投料比n(C3H8):n(O2)=2:1,n(C3H8):n(O2)=1:1,n(C3H8):n(O2)=1:2,得到不同压强条件下C3H8的平衡转化率关系图:
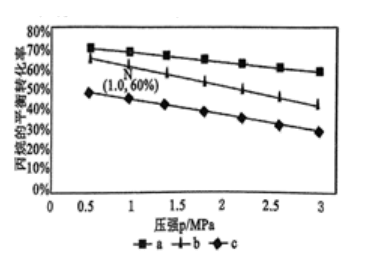
①a、b、c各曲线所表示的投料比大小顺序为___________ (用字母表示)。
②TK平衡时,点N在线b上,计算N点C3H8的体积分数为___________ (保留三位有效数字)。
③TK条件下,某容器测得某时刻p(C3H8)=0.2MPa, p(O2)=0. 7MPa, p(C3H6)=p(H2O)=0. 3MPa,此时,v正:v逆___________ (用 分数表示)。
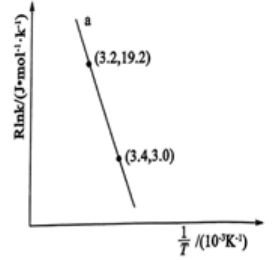
(4)丙烷分解可制取乙烯,发生反应C3H8(g) C2H4(g)+CH4(g),根据Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk= -
C2H4(g)+CH4(g),根据Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk= - +C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=___________ kJ·mol-1。
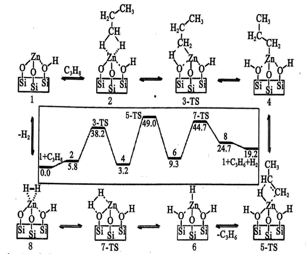
(5)丙烷在催化剂表面脱氢生成丙烯的机理如图所示,TS为过渡态,则决定反应速率快慢的步骤是___________ (填 “2→4”“4→6”“6→8”)。
已知:反应I: C3H8(g)
反应II: H2O(g)
(1)丙烷可氧化直接脱氢发生反应III 2C3H8(g) +O2(g)
(2)向某绝热恒容密闭容器内充入一定量的C3H8和O2,发生反应III.下列能说明该反应达到平衡状态的是___________ (填标号)。
| A.容器内气体的密度不再改变 |
| B.容器内气体的温度不再改变 |
| C.v正(O2)=2v逆 (C3H6) |
| D.容器内气体的平均摩尔质量不再改变 |

①a、b、c各曲线所表示的投料比大小顺序为
②TK平衡时,点N在线b上,计算N点C3H8的体积分数为
③TK条件下,某容器测得某时刻p(C3H8)=0.2MPa, p(O2)=0. 7MPa, p(C3H6)=p(H2O)=0. 3MPa,此时,v正:v逆
(4)丙烷分解可制取乙烯,发生反应C3H8(g)

(5)丙烷在催化剂表面脱氢生成丙烯的机理如图所示,TS为过渡态,则决定反应速率快慢的步骤是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 ΔH=
ΔH=