解答题-结构与性质 适中0.65 引用1 组卷120
2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子排布式_____ 。
(2)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为_____ ,As右边相邻元素X为_____ (填元素符号),与X同周期的p区元素中第一电离能大于X的元素有_____ 种;XO3的空间构型是_____ 。
(3)相同压强下,AsH3的沸点_____ SbH3(填“<”或“>”),原因为_____ 。
(4)现有Ti3+的配合物[TiCl(H2O)5]Cl2•H2O,其中配离子是_____ ,配位数为_____ ,在0.2mol该配合物溶液中滴加足量的AgNO3溶液,产生沉淀的物质的量为_____ 。
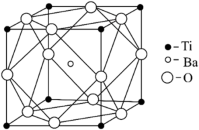
(5)偏钛酸钡晶体中晶胞的结构如图所示,晶胞边长为apm,阿伏伽德罗常数为NA,则该晶体的密度为______ g•cm-3。
(1)基态Ga原子价电子排布式
(2)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为
(3)相同压强下,AsH3的沸点
(4)现有Ti3+的配合物[TiCl(H2O)5]Cl2•H2O,其中配离子是
(5)偏钛酸钡晶体中晶胞的结构如图所示,晶胞边长为apm,阿伏伽德罗常数为NA,则该晶体的密度为

22-23高二下·重庆璧山·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网







