解答题-结构与性质 适中0.65 引用1 组卷176
碳族元素及其化合物有十分丰富的化学性质,请回答:
(1)在有机反应中有许多活性中间体,如在异丁烯与水加成中生成的(CH3)3C+,其中C存在的杂化方式_______ ,其中C+的VSEPR模型是_______ ;在有机化合物中碳上的氢的酸性可由pK描述,K为该氢的电离平衡常数,则CCl3H与CF3H中pK较大的是_______ ,理由是_______ 。
(2)碱金属M( ,
, ,
, 等)可与石墨和
等)可与石墨和 形成化合物。
形成化合物。 与
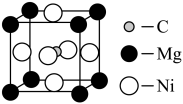
与 作用形成的
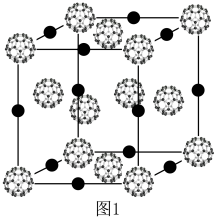
作用形成的 具有三维超导性能,图1为其晶胞,该晶体类型是
具有三维超导性能,图1为其晶胞,该晶体类型是_______ 。
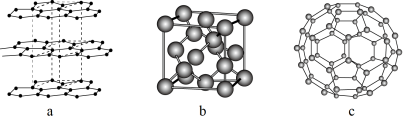
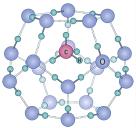
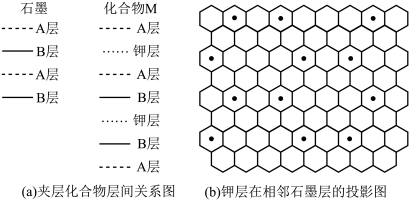
(3)石墨可看成碳层的叠加,六方石墨是abab……的两层循环,三方石墨是abcabc……(a、b、c表示不同的碳层)的三层循环,图2中属于六方石墨的是_______ :石墨与钾蒸汽作用可形成石墨夹层离子化合物,图3所示的化合物的化学式是_______ 。

(4)硅也可形成的一系列氢化物,如甲硅烷能与 猛烈反应,在空气中可以自燃,请说明硅烷化学性质比相应的烷烃活泼的原因
猛烈反应,在空气中可以自燃,请说明硅烷化学性质比相应的烷烃活泼的原因_______ 。
(1)在有机反应中有许多活性中间体,如在异丁烯与水加成中生成的(CH3)3C+,其中C存在的杂化方式
(2)碱金属M(

(3)石墨可看成碳层的叠加,六方石墨是abab……的两层循环,三方石墨是abcabc……(a、b、c表示不同的碳层)的三层循环,图2中属于六方石墨的是

(4)硅也可形成的一系列氢化物,如甲硅烷能与
2023·浙江·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网