解答题-实验探究题 适中0.65 引用1 组卷242
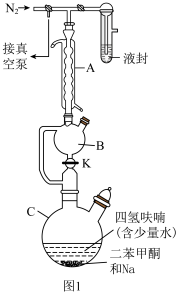
实验室用图装置(夹持、搅拌等装置已省略)制备氢化铝钠( )。
)。
简要步骤如下:
I.在A瓶中分别加入50mL含4.32g NaH的四氢呋喃悬浮液、少量(可忽略) 固体,搅拌,接通冷凝水,控温30℃。
固体,搅拌,接通冷凝水,控温30℃。
II.滴加50mL含5.34g 的四氢呋喃溶液,有白色固体析出。
的四氢呋喃溶液,有白色固体析出。
III.滴加完后,充分搅拌1h,放置沉降,经一系列操作得到产品。
已知:
① 在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃(
在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃(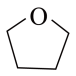 ),难溶于甲苯。常压下,四氢呋喃沸点66℃。
),难溶于甲苯。常压下,四氢呋喃沸点66℃。
②


请回答:
(1)仪器B名称是_______ ;A瓶中冷凝水的通水方向是_______ 进_______ 出(填“a”或“b”)。
(2)请结合主要的化学方程式说明 遇水产生燃烧爆炸现象的原因
遇水产生燃烧爆炸现象的原因_______ 。
(3)下列说法正确的是_______。
(4)步骤III中,经过“一系列操作”得到较纯净且较大颗粒的产品。从下列选项中选择合理的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器或一种试剂,括号内填写一种操作,均用字母表示]。
用_______( )→用_______(洗涤)→用_______( )→粗产品→在烧杯中用_______(溶解,并多次重结晶纯化)→最后一次结晶时→用真空干燥器(干燥)→较纯净且较大颗粒的产品_______ 。
仪器或试剂:a.蒸馏烧瓶;b.三颈烧瓶;c.三角漏斗;d.四氢呋喃;e.甲苯;f.95%乙醇水溶液
操作:g.调控快速结晶;h.调控缓慢结晶;i.过滤;j.减压蒸馏。
(5)产率计算:将步骤III获得的产品用足量的无水乙醇、盐酸处理,加热沸腾分离出 ,冷却后用100mL容量瓶配成溶液。用移液管量取5mL待测溶液、20mL 0.2000mol/L EDTA溶液于锥形瓶中,调节pH值,加热沸腾2min。冷却后加双硫腺指示剂,用0.1000mol/L醋酸锌溶液滴定剩余的EDTA,多次测量消耗的醋酸锌溶液体积平均为20.90mL。则
,冷却后用100mL容量瓶配成溶液。用移液管量取5mL待测溶液、20mL 0.2000mol/L EDTA溶液于锥形瓶中,调节pH值,加热沸腾2min。冷却后加双硫腺指示剂,用0.1000mol/L醋酸锌溶液滴定剩余的EDTA,多次测量消耗的醋酸锌溶液体积平均为20.90mL。则 的产率是
的产率是____ 。(EDTA与 、
、 均形成1:1的螯合物;
均形成1:1的螯合物; )
)

简要步骤如下:
I.在A瓶中分别加入50mL含4.32g NaH的四氢呋喃悬浮液、少量(可忽略)
II.滴加50mL含5.34g
III.滴加完后,充分搅拌1h,放置沉降,经一系列操作得到产品。
已知:
①
 ),难溶于甲苯。常压下,四氢呋喃沸点66℃。
),难溶于甲苯。常压下,四氢呋喃沸点66℃。②
请回答:
(1)仪器B名称是
(2)请结合主要的化学方程式说明
(3)下列说法正确的是_______。
| A.步骤I中,加少量 |
| B.步骤II中,适当减缓滴加 |
| C.步骤III中,“沉降”得到的清液的主要成分为四氢呋喃和 |
| D.考虑到四氢呋喃有一定毒性,装置中 |
用_______( )→用_______(洗涤)→用_______( )→粗产品→在烧杯中用_______(溶解,并多次重结晶纯化)→最后一次结晶时→用真空干燥器(干燥)→较纯净且较大颗粒的产品
仪器或试剂:a.蒸馏烧瓶;b.三颈烧瓶;c.三角漏斗;d.四氢呋喃;e.甲苯;f.95%乙醇水溶液
操作:g.调控快速结晶;h.调控缓慢结晶;i.过滤;j.减压蒸馏。
(5)产率计算:将步骤III获得的产品用足量的无水乙醇、盐酸处理,加热沸腾分离出
2023·浙江·模拟预测
类题推荐
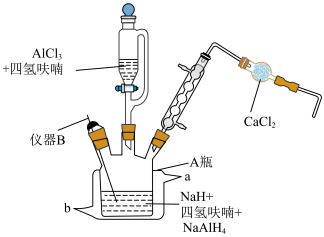
实验室用图1装置(夹持、搅拌、尾气处理装置已省略)制备氢化铝钠( )。
)。
Ⅰ.在瓶A中分别加入50mL含3.84gNaH的四氢呋喃悬浮液、少量NaCl固体和0.20g 固体搅拌,接通冷凝水。
固体搅拌,接通冷凝水。
Ⅱ.滴加50mL含5.34g 的四氢呋喃溶液,反应,有白色固体析出。
的四氢呋喃溶液,反应,有白色固体析出。
Ⅲ.待物料加完后,充分搅拌1h,放置沉降,分离出固体和清液,在图2装置中蒸馏,再纯化。


请回答:
(1)A瓶中冷凝水的通水方向是______ 进______ 出(填“a”或“b”)。
(2)请结合化学方程式说明 遇水产生燃烧爆炸现象的原因
遇水产生燃烧爆炸现象的原因______ 。
(3)下列说法正确的是______。
(4)步骤Ⅰ中,如果不加少量NaCl固体,反应速率逐渐减慢,在未完全滴加 的四氢呋喃溶液前反应停止,请解释原因
的四氢呋喃溶液前反应停止,请解释原因______ 。
(5)若称量纯化后的 质量为1.82g,计算该反应的产率为
质量为1.82g,计算该反应的产率为______ 。
(6)产品分析:分别取粗产品和纯化后的产品测定XDR,实验所测定的X射线衍射图谱如图3、图4所示,纯化后的产品的X射线衍射图谱是______ (填“图3”或“图4”)。

Ⅰ.在瓶A中分别加入50mL含3.84gNaH的四氢呋喃悬浮液、少量NaCl固体和0.20g
Ⅱ.滴加50mL含5.34g
Ⅲ.待物料加完后,充分搅拌1h,放置沉降,分离出固体和清液,在图2装置中蒸馏,再纯化。
在室温干燥空气中能稳定存在,遇水易燃烧爆炸,易溶于四氢呋喃(
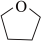 ,缩写为THF),难溶于甲苯、戊烷等烃类有机溶剂。常压下,
,缩写为THF),难溶于甲苯、戊烷等烃类有机溶剂。常压下,熔点178℃,THF沸点66℃。
请回答:
(1)A瓶中冷凝水的通水方向是
(2)请结合化学方程式说明
(3)下列说法正确的是______。
| A.由于THF有一定毒性,所以图1中 |
| B.步骤Ⅱ中,滴加 |
| C.蒸馏时,缓慢加热,收集66℃左右馏分 |
| D.根据物质结构推测,在室温下NaH在THF中的溶解度比 |
(4)步骤Ⅰ中,如果不加少量NaCl固体,反应速率逐渐减慢,在未完全滴加
(5)若称量纯化后的
(6)产品分析:分别取粗产品和纯化后的产品测定XDR,实验所测定的X射线衍射图谱如图3、图4所示,纯化后的产品的X射线衍射图谱是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网