解答题-结构与性质 适中0.65 引用1 组卷77
CuO、Cu2S等含铜化合物可以催化合成HCOOH.回答下列问题:
(1)基态铜原子的价电子排布式为___________ 。
(2)HCOOH中碳原子的轨道杂化类型为___________ ,元素电负性从大到小的顺序为___________ 。
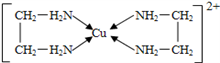
(3)催化过程中可能产生 ,
, 的空间构型为
的空间构型为___________ ,碳氧键的平均键长 比CH3OH要
比CH3OH要___________ (填“长”或“短”)。
(4)在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是___________ 。
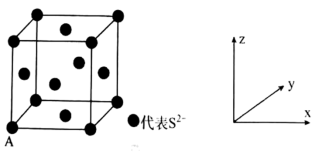
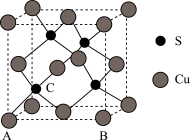
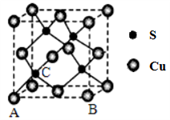
(5)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。
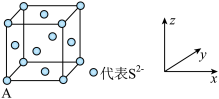
S2-配位数为______________________ ;已知图中A处(S2-)的原子分数坐标为(0,0,0),则晶胞中与A距离最近的为Cu+原子分数坐标为___________ ;若晶胞参数anm,晶体的密度为dg·cm-3),则阿伏加德罗常数的值为___________ (用含a和d的式子表示)。
(1)基态铜原子的价电子排布式为
(2)HCOOH中碳原子的轨道杂化类型为
(3)催化过程中可能产生
(4)在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是
(5)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。

S2-配位数为
2023·江西赣州·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网