填空题 适中0.65 引用1 组卷162
Ⅰ.铝合金和钢铁是国家重要的金属材料。回答下列问题:
(1)下列是气态铝原子或离子的电子排布式,其中处于激发态的有___________ (填序号)。A变为D所需的能量为E1,D变为E所需的能量为E2,则E1___________ E2(填“>”“<”或“=”),理由是___________ 。
A.1s22s22p63s23p1 B.1s22s22p63s13px13py1 C.1s22s22p63s13px13pz1
D.1s22s22p63s2 E.1s22s22p63s1 F.1s22s22p63s13p1
(2)利用电解法可在铝制品表面形成致密的氧化物保护膜,不仅可以增加美观,而且可以延长铝制品使用时间。制取氧化物保护膜的装置如下图所示,阳极的电极反应方程式为___________ 。
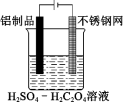
Ⅱ.钢铁在潮湿空气中容易生锈,某兴趣小组查阅资料可知,钢铁腐蚀的快慢与温度、电解质溶液的pH值、氧气浓度以及钢铁中的含碳量有关,为此设计了下列实验。

通过上述实验分析回答:
(3)上述实验①、②探究___________ 对铁的腐蚀快慢的影响,写出实验②碳电极上的电极反应式___________ ;
(4)上述四个实验中___________ (用编号表示)发生吸氧腐蚀,上述四个实验铁腐蚀由快到慢的顺序为___________ (用编号表示)。
(1)下列是气态铝原子或离子的电子排布式,其中处于激发态的有
A.1s22s22p63s23p1 B.1s22s22p63s13px13py1 C.1s22s22p63s13px13pz1
D.1s22s22p63s2 E.1s22s22p63s1 F.1s22s22p63s13p1
(2)利用电解法可在铝制品表面形成致密的氧化物保护膜,不仅可以增加美观,而且可以延长铝制品使用时间。制取氧化物保护膜的装置如下图所示,阳极的电极反应方程式为

Ⅱ.钢铁在潮湿空气中容易生锈,某兴趣小组查阅资料可知,钢铁腐蚀的快慢与温度、电解质溶液的pH值、氧气浓度以及钢铁中的含碳量有关,为此设计了下列实验。

| 编号 | ① | ② | ③ | ④ |
| A | 100 mL饱和NaCl溶液 | 100 mL饱和NaCl溶液 | 100 mLpH = 2 CH3COOH | 100 mLpH = 5 H2SO4 |
| B | m g铁粉 | m g铁粉和n g碳粉混合物 | m g铁粉和n g碳粉混合物 | m g铁粉和n g碳粉混合物 |
| 锥形瓶中压强随时间变化 | 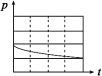 | 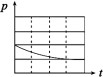 | 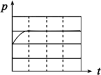 |  |
通过上述实验分析回答:
(3)上述实验①、②探究
(4)上述四个实验中
22-23高二下·四川成都·期中
类题推荐
I.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如表,请回答下列问题.
(1)实验①②研究的是____ 对化学反应速率的影响,V1=____ 。
(2)实验①③研究的是____ 对化学反应速率的影响,V2=____ 。
(3)t1、t2、t3由大到小的顺序是____ 。
II.某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示:
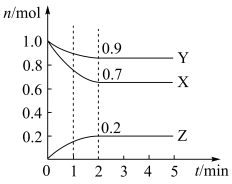
(4)由图中所给数据进行分析,该反应的化学方程式为____ 。
(5)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如表所示:
50-150s内的平均反应速率v(N2)=____ 。
(6)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。N≡N的键能为946kJ/mol,H—H的键能为436kJ/mol,N—H的键能为391kJ/mol,则生成1molNH3过程中的能量变化为____ (填”吸收”或”放出”及能量大小),反应达到(5)中的平衡状态时,对应的能量变化的数值为___ kJ。
(7)为加快反应速率,可以采取的措施是____ 。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
| 实验编号 | 反应温度 | 加入0.1mol/LNa2S2O3溶液的体积 | 加入0.1mol/LH2SO4溶液的体积 | 加入水的体积 | 出现浑浊的时间 |
| ℃ | mL | mL | mL | s | |
| ① | 20 | 2 | 2 | 0 | t1 |
| ② | 40 | 2 | V1 | 0 | t2 |
| ③ | 20 | 1 | 2 | V2 | t3 |
(1)实验①②研究的是
(2)实验①③研究的是
(3)t1、t2、t3由大到小的顺序是
II.某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示:

(4)由图中所给数据进行分析,该反应的化学方程式为
(5)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
50-150s内的平均反应速率v(N2)=
(6)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。N≡N的键能为946kJ/mol,H—H的键能为436kJ/mol,N—H的键能为391kJ/mol,则生成1molNH3过程中的能量变化为
(7)为加快反应速率,可以采取的措施是
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
在生产和生活中,人们关注化学反应进行的快慢和程度,以提高生产效率和调控反应条件。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为 。
。
(1)德国化学家F·Haber利用 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。_______ 。
A.氢气燃烧 B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是_______ 。
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的
D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的 和
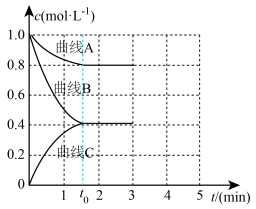
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。 变化的曲线是
变化的曲线是_______ (填“A”“B”或“C”)。
②下列能说明该反应达到平衡状态的是_______ (填序号)。
a.容器中的压强不随时间变化
b.
c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol 的同时生成2mol
的同时生成2mol
e.容器内 的质量分数不变
的质量分数不变
(3)一定条件下,将2mol 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为_______ , 的转化率是
的转化率是_______ ,混合气中 的物质的量分数是
的物质的量分数是_______ 。
Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠( )与硫酸反应速率的影响。
)与硫酸反应速率的影响。
【查阅资料】
a. 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应:
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
实验数据:
(4)选用浊度计进行测量,原因是 溶液与
溶液与 溶液反应生成了
溶液反应生成了_______ 。
(5)实验③中,x=_______ 。
(6)实验①、②、③的目的是_______ 。
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是_______ 。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为
(1)德国化学家F·Haber利用
 、
、 、
、 分别
分别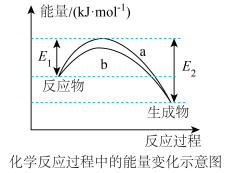
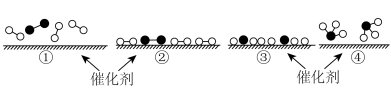
A.氢气燃烧 B.氯化铵与
C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的
D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的
②下列能说明该反应达到平衡状态的是
a.容器中的压强不随时间变化
b.
c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol
e.容器内
(3)一定条件下,将2mol
Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠(
【查阅资料】
a.
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
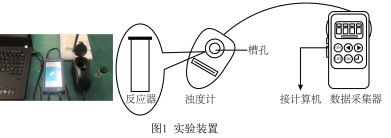
| 实验编号 | 蒸馏水 | ||||
| V/mL | V/mL | V/mL | |||
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
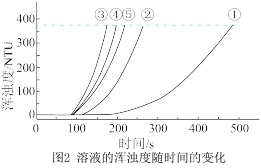
(4)选用浊度计进行测量,原因是
(5)实验③中,x=
(6)实验①、②、③的目的是
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对
化学反应的能量变化通常表现为热量的变化,因此反应热的研究对于化学学科发展具有重要意义。
Ⅰ.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1
下列结论中正确的是__ 。
A.碳的燃烧热等于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
D.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:
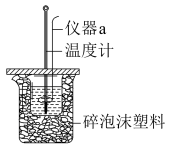
①用量筒量取100mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取100mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)仪器a的名称是__ 。烧杯间填满碎泡沫塑料的作用是__ 。
(2)配制100mL0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平、烧杯、钥匙、镊子、玻璃棒、量筒以及___ 。
(3)实验中改用80mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__ (填“相等”“不相等”)。反应过程中NaOH溶液的浓度为0.55mol·L-1不是0.50mol·L-1的原因是___ 。用Ba(OH)2溶液和硫酸代替上述试剂,所测中和热的数值__ 。(填“偏大”、“偏小”或“不变”)
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__ 。
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=__ (结果保留一位小数)。
(6)高锰酸钾是化学实验中的常用试剂。
Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,回答下面问题:
发生反应的离子方程式为:___ 。
某同学探究“外界条件改变对化学反应速率的影响”进行了如下实验:
①通过A与B,A与C进行对比实验,填写下列数值,T1=__ K;V3=__ mL。
②该实验配合使用计时器,通过测定__ 所需的时间,来确定不同条件下速率的相对快慢。
Ⅰ.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1
下列结论中正确的是
A.碳的燃烧热等于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
D.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取100mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取100mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)仪器a的名称是
(2)配制100mL0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平、烧杯、钥匙、镊子、玻璃棒、量筒以及
(3)实验中改用80mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.3 | 20.5 | 25.6 |
(6)高锰酸钾是化学实验中的常用试剂。
Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,回答下面问题:
发生反应的离子方程式为:
某同学探究“外界条件改变对化学反应速率的影响”进行了如下实验:
| 实验序号 | 实验温度/K | 参加反应的物质 | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | V3 |
②该实验配合使用计时器,通过测定
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


