填空题 适中0.65 引用1 组卷144
某研究小组对甲醛的性质进行推测和验证。
Ⅰ.性质推测:
同学甲认为,甲醛的性质应该与乙醛类似,在加热的条件下甲醛可以与新制Cu(OH)2悬浊液反应,且产物是Cu2O和甲酸钠。
(1)写出同学甲所预期的该反应的化学方程式___________ 。
Ⅱ.实验验证:
向3.5 mL新制氢氧化铜碱性悬浊液中加40%福尔马林溶液2mL,加热,有较多无色气
泡逸出。最终试管内所得红色沉淀与乙醛跟氢氧化铜悬浊液反应所得的固体颜色有所不同,试管内壁沉积了一层紫红色的固体物质。
同学甲分别对实验过程中产生的红色沉淀及气体的成分进行探究。
(2)取少量实验中所得的红色沉淀于试管中,加入适量浓氨水,振荡,溶液颜色无明显变化,静置数小时后,溶液颜色略呈浅蓝色,但试管底部红色沉淀的量变化不大。由此判断红色沉淀可能是___________ (写化学式)。用离子方程式解释溶液略呈浅蓝色的原因___________ 。
(3)为进一步验证上述结论,另取少量实验中所得的红色沉淀于试管,加入___________ 。
a.稀硫酸 b.稀硝酸 c.浓硝酸
若观察到___________ 的现象,可证明前面判断正确。
(4)同学甲认为无色气体可能是二氧化碳、甲醛或两者的混合气体。同学乙认为该气体中不可能含有二氧化碳,理由是___________ ,乙同学将产生的无色气体通入银氨溶液,水浴加热,试管壁上很快就有银镜形成。
同学们据此实验现象判断:无色气体的成分是甲醛。
(5)甲乙两同学进一步查阅资料,发现无色气体的主要成分也可能是CO。设计如下实验方案,进一步探究:

实验现象:氧化铜由黑变红、澄清石灰水变浑浊。
方案中水洗的目的是___________ 。
Ⅰ.性质推测:
同学甲认为,甲醛的性质应该与乙醛类似,在加热的条件下甲醛可以与新制Cu(OH)2悬浊液反应,且产物是Cu2O和甲酸钠。
(1)写出同学甲所预期的该反应的化学方程式
Ⅱ.实验验证:
向3.5 mL新制氢氧化铜碱性悬浊液中加40%福尔马林溶液2mL,加热,有较多无色气
泡逸出。最终试管内所得红色沉淀与乙醛跟氢氧化铜悬浊液反应所得的固体颜色有所不同,试管内壁沉积了一层紫红色的固体物质。
| 【资料】 ① 甲醛属于强还原剂,在碱性条件下还原性更强,在空气中能缓慢氧化成甲酸。 ② CO也能还原银氨溶液产生银镜。 ③ Cu2O在酸性溶液中能转化为Cu2+、Cu。 ④ Cu2O能溶于浓氨水形成无色配合物离子[Cu(NH3)2]+,并在空气中立即被氧化为蓝色的[Cu(NH3)4]2+。置于空气中,Cu也能缓慢溶于浓氨水生成蓝色的[Cu(NH3)4]2+。 |
(2)取少量实验中所得的红色沉淀于试管中,加入适量浓氨水,振荡,溶液颜色无明显变化,静置数小时后,溶液颜色略呈浅蓝色,但试管底部红色沉淀的量变化不大。由此判断红色沉淀可能是
(3)为进一步验证上述结论,另取少量实验中所得的红色沉淀于试管,加入
a.稀硫酸 b.稀硝酸 c.浓硝酸
若观察到
(4)同学甲认为无色气体可能是二氧化碳、甲醛或两者的混合气体。同学乙认为该气体中不可能含有二氧化碳,理由是
同学们据此实验现象判断:无色气体的成分是甲醛。
(5)甲乙两同学进一步查阅资料,发现无色气体的主要成分也可能是CO。设计如下实验方案,进一步探究:

实验现象:氧化铜由黑变红、澄清石灰水变浑浊。
方案中水洗的目的是
22-23高二下·北京西城·期中
类题推荐  易溶于水、乙醇和乙醚,常用作漂白剂和还原剂,
易溶于水、乙醇和乙醚,常用作漂白剂和还原剂, 在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备
在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
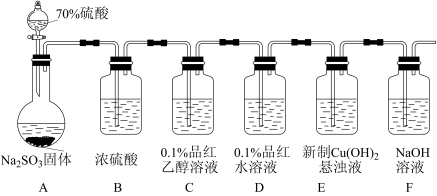
(1)装置B中浓硫酸的作用是_______ ;实验中观察到:装置C中溶液红色没有褪去,装置D中溶液红色褪去。由此可得出的结论是_______ 。
(2)为了进一步探究使品红褪色的主要微粒,进行如下系列实验:
综合上述实验推知, 水溶液使品红褪色时起主要作用的微粒是
水溶液使品红褪色时起主要作用的微粒是_______ (填微粒符号)。
(3)用 溶液和
溶液和 溶液制备
溶液制备 悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与
悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与 溶液、
溶液、 溶液的颜色明显不同。
溶液的颜色明显不同。
①为探究白色沉淀的成分,查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸,与氨水反应生成 ,在空气中立即被氧化成含有蓝色
,在空气中立即被氧化成含有蓝色 的溶液。
的溶液。
甲同学向洗涤后的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为 、
、_______ 。
乙同学设计一个简单实验方案证明白色沉淀为CuCl:_______ ;装置E中生成白色沉淀的离子方程式为_______ 。
②为探究E中溶液呈绿色而不是蓝色的原因,向 溶液中通入过量
溶液中通入过量 ,未见溶液颜色发生变化,目的是
,未见溶液颜色发生变化,目的是_______ ;取少量E中滤液,加入少量稀盐酸,产生无色刺激性气味气体,得到澄清蓝色溶液,故推断溶液显绿色的原因可能是溶液中含有较多 。为进一步实验确认这种可能性,向少量
。为进一步实验确认这种可能性,向少量 溶液中加入
溶液中加入_______ (填化学式),得到绿色溶液。
某研究性学习小组在做Cu 和浓HNO3、稀HNO3反应时,发现生成溶液的颜色有差别。Cu和浓HNO3反应后的溶液为鲜艳草绿色,而Cu和稀HNO3反应溶液为蓝色。
(1)写出Cu和浓HNO3反应的化学方程式:______ 。
(2)该研究性小组成员对反应后生成的溶液颜色差别进行了实验探究。
甲同学认为:绿色是硝酸铜溶液浓度较大引起的,即Cu(NO3)2浓溶液显绿色,Cu(NO3)2稀溶液显蓝色。
乙同学认为:绿色是NO2溶于Cu2+溶液引起的。
①甲同学用Cu(NO3)2晶体配制成稀溶液,溶液为浅蓝色,随着Cu(NO3)2固体的加入,最终配成饱和溶液,颜色逐渐变深,但始终是蓝色。该现象可证明甲同学推测______ (填“合理”或“不合理”)。
②乙同学将Cu与浓HNO3反应后的绿色溶液稍微加热,放出大量红棕色气体,溶液变为______ 色,证明乙同学推测可能成立。
③乙同学设计实验进一步探究,向不同浓度的铜盐溶液中通入NO2气体,实验数据和实验现象如下表:
不同浓度铜盐溶液中通入NO2气体的现象
对比实验1和2,或对比实验3和4,可以得到结论______ 。对比铜与浓硝酸的反应,生成的部分NO2 也会溶入溶液,使溶液呈现绿色。说明“反应混合液”呈绿色确实与NO2气体溶解有关。
(3)丙同学查阅文献:浓硝酸和铜的反应因为有亚硝酸(HNO2)生成,进而可以和Cu2+ 结合成亚硝酸化合物,而铜的亚硝酸化合物是绿色的。
①丙同学设计实验验证生成了亚硝酸(HNO2),取一支试管加入浓硝酸1 mL,插入铜丝后,快速反应,有红棕色气体放出,溶液为绿色;然后加入3滴30%的H2O2溶液,振荡后溶液变为蓝色。分析原因是H2O2和反应过程中生成的HNO2发生了氧化还原反应,写出H2O2和HNO2反应的化学方程式:______ 。
②丙同学继续设计实验验证。取1 mol/LCu(NO3)2溶液2 mL,加入1 mol/L的NaNO2溶液3滴,观察溶液变为绿色,再加入3滴30%H2O2和1滴浓硝酸。溶液很快由绿色变为蓝色。由此可以得到Cu和浓HNO3反应后的溶液为绿色的原因是:______ 。
(1)写出Cu和浓HNO3反应的化学方程式:
(2)该研究性小组成员对反应后生成的溶液颜色差别进行了实验探究。
甲同学认为:绿色是硝酸铜溶液浓度较大引起的,即Cu(NO3)2浓溶液显绿色,Cu(NO3)2稀溶液显蓝色。
乙同学认为:绿色是NO2溶于Cu2+溶液引起的。
①甲同学用Cu(NO3)2晶体配制成稀溶液,溶液为浅蓝色,随着Cu(NO3)2固体的加入,最终配成饱和溶液,颜色逐渐变深,但始终是蓝色。该现象可证明甲同学推测
②乙同学将Cu与浓HNO3反应后的绿色溶液稍微加热,放出大量红棕色气体,溶液变为
③乙同学设计实验进一步探究,向不同浓度的铜盐溶液中通入NO2气体,实验数据和实验现象如下表:
不同浓度铜盐溶液中通入NO2气体的现象
| 实验编号 | ① | ② | ③ | ④ |
| 饱和Cu(NO3)2溶液体积/mL | 2 | 1 | 0 | 0 |
| 蒸馏水体积/mL | 0 | 1 | 0 | 1 |
| 饱和CuSO4溶液体积/mL | 0 | 0 | 2 | 1 |
| 现象 | 蓝绿色 | 蓝绿色 | 绿色 | 绿色 |
(3)丙同学查阅文献:浓硝酸和铜的反应因为有亚硝酸(HNO2)生成,进而可以和Cu2+ 结合成亚硝酸化合物,而铜的亚硝酸化合物是绿色的。
①丙同学设计实验验证生成了亚硝酸(HNO2),取一支试管加入浓硝酸1 mL,插入铜丝后,快速反应,有红棕色气体放出,溶液为绿色;然后加入3滴30%的H2O2溶液,振荡后溶液变为蓝色。分析原因是H2O2和反应过程中生成的HNO2发生了氧化还原反应,写出H2O2和HNO2反应的化学方程式:
②丙同学继续设计实验验证。取1 mol/LCu(NO3)2溶液2 mL,加入1 mol/L的NaNO2溶液3滴,观察溶液变为绿色,再加入3滴30%H2O2和1滴浓硝酸。溶液很快由绿色变为蓝色。由此可以得到Cu和浓HNO3反应后的溶液为绿色的原因是:
化学实验小组对乙醛与新制的Cu(OH)2悬浊液反应的实验进行探究。
甲同学:取2mL10%的氢氧化钠溶液于试管中,滴入2%的CuSO4溶液4滴,得到新制备的氢氧化铜,振荡后加入40%的乙醛溶液0.5ml,加热煮沸,产生了砖红色沉淀。
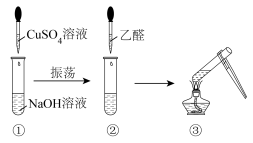
(1)证明乙醛和新制的Cu(OH)2悬浊液反应的现象为:___ 。
(2)乙醛与新制的Cu(OH)2悬浊液发生反应的化学方程式为:___ 。
乙同学:取2mL2%的CuSO4溶液于试管中,滴入10%的NaOH溶液4滴,振荡后加入40%的乙醛溶液0.5ml,加热煮沸,结果未观察到砖红色沉淀。
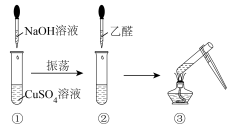
针对实验,乙同学查阅了大量的文献资料,对实验进行了深入的探究,认为氢氧化钠溶液的用量对实验的成败很关键,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
文献资料:①Cu2(OH)2SO4为浅蓝色沉淀,很稳定,受热不易分解。
②Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。
(3)上表中a为___ mL,b为___ mL。
(4)根据上表的数据及现象分析,写出实验1中产生浅蓝色沉淀的化学方程式为:___ 。
(5)实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,请从上表中找出相应的现象证据为___ 。
(6)为了进一步证明实验4中红色沉淀的成分,并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液,加入___ 溶液振荡,观察到___ ,则证明红色沉淀为Cu2O。
(7)基于上述实验,该小组同学获得结论:乙醛参与反应,能生成红色沉淀时,需控制体系的pH的范围为___ 。
甲同学:取2mL10%的氢氧化钠溶液于试管中,滴入2%的CuSO4溶液4滴,得到新制备的氢氧化铜,振荡后加入40%的乙醛溶液0.5ml,加热煮沸,产生了砖红色沉淀。

(1)证明乙醛和新制的Cu(OH)2悬浊液反应的现象为:
(2)乙醛与新制的Cu(OH)2悬浊液发生反应的化学方程式为:
乙同学:取2mL2%的CuSO4溶液于试管中,滴入10%的NaOH溶液4滴,振荡后加入40%的乙醛溶液0.5ml,加热煮沸,结果未观察到砖红色沉淀。

针对实验,乙同学查阅了大量的文献资料,对实验进行了深入的探究,认为氢氧化钠溶液的用量对实验的成败很关键,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | 红色沉淀 |
②Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。
(3)上表中a为
(4)根据上表的数据及现象分析,写出实验1中产生浅蓝色沉淀的化学方程式为:
(5)实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,请从上表中找出相应的现象证据为
(6)为了进一步证明实验4中红色沉淀的成分,并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液,加入
(7)基于上述实验,该小组同学获得结论:乙醛参与反应,能生成红色沉淀时,需控制体系的pH的范围为

(1)装置B中浓硫酸的作用是
(2)为了进一步探究使品红褪色的主要微粒,进行如下系列实验:
| 实验 | 试管中的溶液 | 滴入溶液 | 实验现象 |
| a | 各滴入1滴0.1%品红溶液 | 溶液变红逐渐变浅,约90s后完全褪色 | |
| b | 溶液变红后立即变浅,约15s后完全褪色 | ||
| c | 溶液变红后立即褪色 |
(3)用
①为探究白色沉淀的成分,查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸,与氨水反应生成
甲同学向洗涤后的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为
乙同学设计一个简单实验方案证明白色沉淀为CuCl:
②为探究E中溶液呈绿色而不是蓝色的原因,向
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


