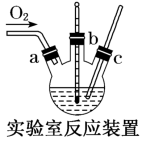
解答题-实验探究题 适中0.65 引用2 组卷307
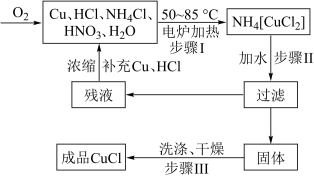
实验室以废铜屑为原料制取碱式碳酸铜[ ]的流程如下:
]的流程如下:

已知:
①废铜屑的主要杂质有CuO、 、
、 、FeO和
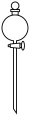
、FeO和 ,“酸浸”使用的装置如图;
,“酸浸”使用的装置如图;
②相关数据见下表:
请回答:
(1)仪器Y的名称是___________ ,溶液Z的作用是___________ 。
(2)流程中需要对滤液加热至70℃但又不宜过高,理由是___________ 。
(3)下列有关说法正确的是___________ 。
A.“酸浸”装置鼓入的 也可用空气代替
也可用空气代替
B.物质X可能是CuO、NaOH溶液或浓氨水
C.滤渣的主要成分是 、
、 、
、 和
和
D.流程中两次对溶液调pH,其调节范围和操作目的均不相同
E.“系列操作”包括了充分搅拌、趁热过滤、蒸馏水洗和灼烧等步骤
(4)可采用滴定法、热重分析法分别对碱式碳酸铜[ ]的组成进行分析。
]的组成进行分析。
①滴定法测定时需要用到酸式滴定管。其中,滴定步骤前可能需要的操作如下,请从中选出正确的操作并按序列出字母:______
向滴定管加蒸馏水并观察是否漏液______→______→______→______→______→______→在滴定管架上竖直放置,静置后读数
a.用蒸馏水洗涤滴定管,再用标准溶液润洗
b.将活塞旋转180°后静置观察
c.使滴定管略倾斜,捏住橡皮管内玻璃球赶走管尖气泡
d.向滴定管中加入标准液并高于“0”刻度
e.竖直滴定管,调整标准液液面低于“0”刻度
f.一手握住并倾斜滴定管,一手开关活塞赶走管尖气泡
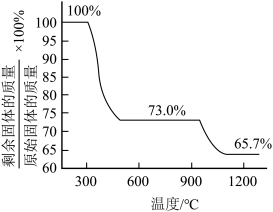
②测得碱式碳酸铜[ ]的热重分析结果如图所示,已知失重至65.7%时固体呈砖红色,则计算可知
]的热重分析结果如图所示,已知失重至65.7%时固体呈砖红色,则计算可知
___________ (保留3位有效数字)。


已知:
①废铜屑的主要杂质有CuO、

②相关数据见下表:
| 物质 | ||||
| 开始沉淀pH | 1.9 | 6.5 | 4.2 | 3.4 |
| 沉淀完全pH | 3.2 | 9.7 | 6.7 | 4.0 |
(1)仪器Y的名称是
(2)流程中需要对滤液加热至70℃但又不宜过高,理由是
(3)下列有关说法正确的是
A.“酸浸”装置鼓入的
B.物质X可能是CuO、NaOH溶液或浓氨水
C.滤渣的主要成分是
D.流程中两次对溶液调pH,其调节范围和操作目的均不相同
E.“系列操作”包括了充分搅拌、趁热过滤、蒸馏水洗和灼烧等步骤
(4)可采用滴定法、热重分析法分别对碱式碳酸铜[
①滴定法测定时需要用到酸式滴定管。其中,滴定步骤前可能需要的操作如下,请从中选出正确的操作并按序列出字母:
向滴定管加蒸馏水并观察是否漏液______→______→______→______→______→______→在滴定管架上竖直放置,静置后读数
a.用蒸馏水洗涤滴定管,再用标准溶液润洗
b.将活塞旋转180°后静置观察
c.使滴定管略倾斜,捏住橡皮管内玻璃球赶走管尖气泡
d.向滴定管中加入标准液并高于“0”刻度
e.竖直滴定管,调整标准液液面低于“0”刻度
f.一手握住并倾斜滴定管,一手开关活塞赶走管尖气泡
②测得碱式碳酸铜[

2023·浙江·三模
类题推荐
实验室以废铜屑(杂质为CuO、Al2O3、Fe2O3、FeO和SiO2)为原料制取碱式碳酸铜[aCu(OH)2·bCuCO3]的流程如下:
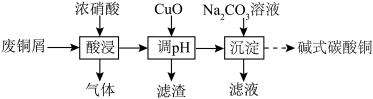
已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
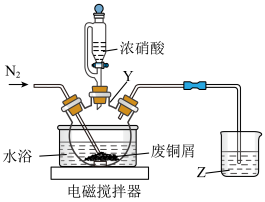
(1)按如图所示的装置加料后进行“酸浸”操作。

①提高Cu元素浸出速率的方法还有___________ 。
②与使用如图所示漏斗相比,使用漏斗Y的优点是___________ 。
(2)“调pH”的合理范围是___________ 。
(3)“沉淀”时需要对混合物加热至70℃但又不宜过高,理由是___________ 。
(4)可采用滴定法、热重分析法分别对碱式碳酸铜的组成进行分析。
①滴定法涉及的部分反应:2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6。请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。___________ ;根据数据计算Cu元素含量(须使用的试剂:KI溶液、0.1000mol/LNa2S2O3溶液、淀粉溶液)。
②测得碱式碳酸铜的热重分析结果如图所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知
___________ (保留3位有效数字)。

已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 6.5 | 4.2 | 3.4 |
| 沉淀完全pH | 3.2 | 9.7 | 6.7 | 4.0 |
(1)按如图所示的装置加料后进行“酸浸”操作。

①提高Cu元素浸出速率的方法还有
②与使用如图所示漏斗相比,使用漏斗Y的优点是

(2)“调pH”的合理范围是
(3)“沉淀”时需要对混合物加热至70℃但又不宜过高,理由是
(4)可采用滴定法、热重分析法分别对碱式碳酸铜的组成进行分析。
①滴定法涉及的部分反应:2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6。请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。
②测得碱式碳酸铜的热重分析结果如图所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知

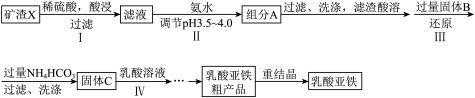
乳酸亚铁[CH3CH(OH)COO]2Fe·3H2O是一种常见的食品铁强化剂,溶于水,难溶于乙醇。某研究小组以矿渣X(主要成分是Fe2O3,含少量Al2O3、SiO2杂质)制备乳酸亚铁并进行产品Fe2+含量测定,制备流程如下(部分环节已略去):
② ;
; (无色配离子)。
(无色配离子)。
请回答:
(1)步骤 ,转化时使用如图装置,仪器A的名称是
,转化时使用如图装置,仪器A的名称是___________ 。
(3)对产品中Fe2+质量百分含量测定,实验室常用已知浓度的Ce(SO4)2标准溶液进行滴定。
①请选择正确的顺序,完成滴定前的准备工作。___________
(___________)→(___________)→装液→(___________)→(___________)→用滴定管量取一定体积的Fe2+溶液,加指示剂,准备开始滴定。
A.蒸馏水洗涤酸式滴定管
B.蒸馏水洗涤碱式滴定管
C.润洗,控制活塞,将洗涤液从滴定管下部放出,重复操作2-3次
D.润洗,将洗涤液从滴定管上口排出,重复操作2-3次
E.橡皮管向上弯曲,挤压玻璃珠,放液排气
F.打开活塞快速放液排气
G.调整液面至0或0刻度以下,记录读数
②滴定操作前需向溶液中加入一定量磷酸溶液,理由是:___________ 、___________ (写出两个理由)。
③称取2.800g乳酸亚铁产品溶于蒸馏水,定容至250mL,进行如下实验:每次取25.00mL试液,用0.1000mol/L的Ce(SO4)2标准溶液滴定至终点。
滴定反应为: 。
。
读数如下:
则该产品中Fe2+质量百分含量为___________ %;有同学改用高锰酸钾标准液进行滴定,操作步骤无差错,测得Fe2+含量总比真实值高,原因是___________ 。
| 金属氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.2 | 3.4 |
| Al(OH)3 | 4.1 | 5.4 |
请回答:
(1)步骤
| A.步骤 |
| B.步骤 |
| C.重结晶后可选择乙醇洗涤晶体 |
| D.为得到干燥的乳酸亚铁晶体,采用高温烘干的方式 |
(3)对产品中Fe2+质量百分含量测定,实验室常用已知浓度的Ce(SO4)2标准溶液进行滴定。
①请选择正确的顺序,完成滴定前的准备工作。
(___________)→(___________)→装液→(___________)→(___________)→用滴定管量取一定体积的Fe2+溶液,加指示剂,准备开始滴定。
A.蒸馏水洗涤酸式滴定管
B.蒸馏水洗涤碱式滴定管
C.润洗,控制活塞,将洗涤液从滴定管下部放出,重复操作2-3次
D.润洗,将洗涤液从滴定管上口排出,重复操作2-3次
E.橡皮管向上弯曲,挤压玻璃珠,放液排气
F.打开活塞快速放液排气
G.调整液面至0或0刻度以下,记录读数
②滴定操作前需向溶液中加入一定量磷酸溶液,理由是:
③称取2.800g乳酸亚铁产品溶于蒸馏水,定容至250mL,进行如下实验:每次取25.00mL试液,用0.1000mol/L的Ce(SO4)2标准溶液滴定至终点。
滴定反应为:
读数如下:
| 实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 9.32 |
| 2 | 0.50 | 9.78 |
| 3 | 0.40 | 10.40 |
| 4 | 0.55 | 9.85 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网