解答题-原理综合题 困难0.15 引用1 组卷522
低碳烯烃是基础有机化工原料,工业上可利用合成气直接或间接制取。主要反应方程式如下。
间接制取低碳烯烃:CO(g)+2H2(g) CH3OH(l) △H1=-116kJ•mol-1
CH3OH(l) △H1=-116kJ•mol-1
2CH3OH(l) C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
C2H4(g)+2H2O(l) △H2=-35kJ•mol-1
直接制取低碳烯烃:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H3
C2H4(g)+2H2O(g) △H3
回答下列问题:
(1)已知H2O(g) H2O(l) △H=-44kJ•mol-1,则△H3=
H2O(l) △H=-44kJ•mol-1,则△H3=______ kJ/mol。
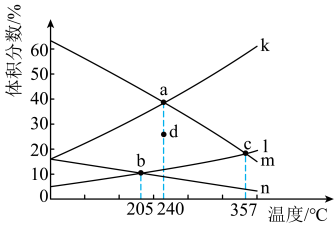
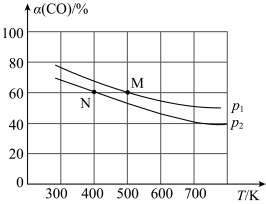
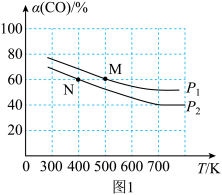
(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1______ P2(填“>”“<”或“=”),M点的正反应速率______ N点的逆反应速率(填“>”“<”或“=”)。在500K,压强为P1的条件下,该反应的Kp=______ (列出计算式)。
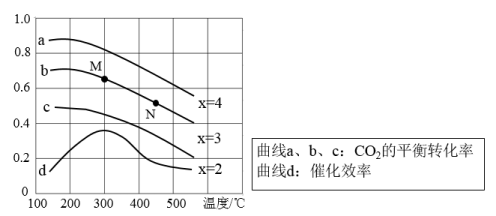
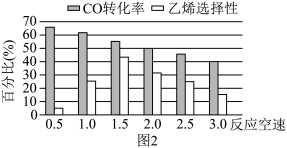
(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性= ×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是
×100%]的影响如图2所示。随着反应空速的增加,乙烯的选择性先升高后降低的原因是______ 。
(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是______ 。
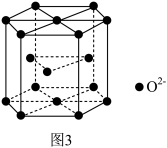
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=______ m3/mol。
间接制取低碳烯烃:CO(g)+2H2(g)
2CH3OH(l)
直接制取低碳烯烃:2CO(g)+4H2(g)
回答下列问题:
(1)已知H2O(g)
(2)将N2、CO和H2以体积比为1:1:2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图1所示,则P1

(3)已知反应空速是指一定条件下,单位时间单位体积(或质量)催化剂处理的气体量。在常压、450℃,n(CO):n(H2)为1:2的条件下,利用合成气直接制取乙烯。反应空速对CO转化率和乙烯选择性[选择性=

(4)利用合成气制取低碳烯烃时,需使合成气吸附在催化剂表面的活性位点上。研究发现催化剂晶体的颗粒越小,催化效果越好,其理由是
(5)Ga2O3是工业上利用合成气制低碳烯烃的催化剂,其晶体结构单元如图3所示(O2-之间紧密堆积,Ga3+位于O2-形成的空隙中且未画出),其中O2-半径为anm,晶体结构单元的高为bnm。已知阿伏加德罗常数的值为NA,则Ga2O3晶体的摩尔体积Vm=

2023·湖北武汉·模拟预测
类题推荐
近年来利用限域催化原理高选择性地将合成气直接制乙烯、丙烯等低碳烯烃工业,因具有流程短、能耗和煤耗低的优势,是目前煤制烯烃过程的一个研究热点。请回答下列问题:
(1)已知合成气制乙烯的热化学方程式为:2CO(g)+4H2(g) C2H4(g)+2H2O(g) ΔH = –231 kJ/mol
C2H4(g)+2H2O(g) ΔH = –231 kJ/mol
已知相关化学键的键能如下表所示,则表中的x=___________ 。
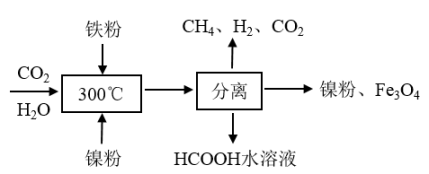
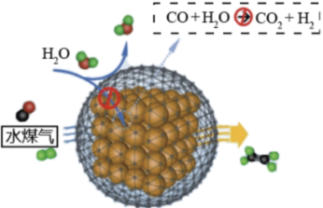
(2)新型Fe基复合催化剂高效抑制CO2生成,实现水煤气直接制取烯烃,原理如图所示。下列说法正确的是
(3)在容积为1 L的密闭容器中以2∶1充入H2和 CO,在一定条件下发生反应:2CO(g)+4H2(g)  C2H4(g)+2H2O(g) ΔH = –231 kJ/mol,CO的平衡转化率与温度的关系如图所示。
C2H4(g)+2H2O(g) ΔH = –231 kJ/mol,CO的平衡转化率与温度的关系如图所示。
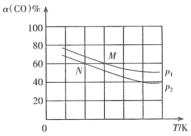
比较:P1___________ P2,M点的正反应速率___________ N点的逆反应速率。(填“>”“<”或“=”)
(4)某温度下,往体积为1 L的刚性容器中加入1 mol CO、2mol H2,在催化剂的作用下发生如下两个反应:
Ⅰ. 2CO(g)+4H2(g) C2H4(g)+2H2O(g);
C2H4(g)+2H2O(g);
Ⅱ. 3CO(g)+6H2(g) C3H6(g)+3H2O(g)
C3H6(g)+3H2O(g)
达到平衡时C2H4的体积分数为 ,CO的转化率为80%,则C2H4的选择性为
,CO的转化率为80%,则C2H4的选择性为___________ 。( )。反应Ⅰ的平衡常数K=
)。反应Ⅰ的平衡常数K=___________ 。
(5)在常压、450℃、H2∶CO为2∶1的条件下,反应空速对CO转化率和乙烯选择性的影响如下图所示。已知:反应空速是指一定条件下,单位时间单位体积催化剂处理的气体量。

分析随着反应空速的增加,乙烯的选择性先升高后降低的原因是___________ 。
(6)在常压、H2:CO为2:1的条件下,经过相同反应时间(未达平衡)测得如下实验数据:
表中数据表明,在相同温度下不同的催化剂对CO转化为乙烯的选择性有显著的影响,其原因是______ 。
(1)已知合成气制乙烯的热化学方程式为:2CO(g)+4H2(g)
已知相关化学键的键能如下表所示,则表中的x=
| 化学键 | C≡O | H‒H | H‒O | C=C | C‒H |
| 键能/ KJ•mol-1 | x | 436 | 465 | 615 | 413 |

| A.该方法主要利用了催化剂改变反应活化能 |
| B.水煤气制取乙烯的反应中有极性键、非极性键的断裂和生成 |
| C.CO2分子和与乙烯分子空间构型相同 |
| D.与传统方法相比,该方法中反应的焓变小,产率高 |

比较:P1
(4)某温度下,往体积为1 L的刚性容器中加入1 mol CO、2mol H2,在催化剂的作用下发生如下两个反应:
Ⅰ. 2CO(g)+4H2(g)
Ⅱ. 3CO(g)+6H2(g)
达到平衡时C2H4的体积分数为
(5)在常压、450℃、H2∶CO为2∶1的条件下,反应空速对CO转化率和乙烯选择性的影响如下图所示。已知:反应空速是指一定条件下,单位时间单位体积催化剂处理的气体量。

分析随着反应空速的增加,乙烯的选择性先升高后降低的原因是
(6)在常压、H2:CO为2:1的条件下,经过相同反应时间(未达平衡)测得如下实验数据:
| T(℃) | 催化剂 | CO转化率(%) | 乙烯选择性(%) |
| 450 | Fe-Mo-cat | 23.5 | 46.3 |
| 450 | Fe基复合催化剂 | 33.8 | 26.8 |
| 450 | 碳纳米管限域催化 | 43.5 | 58.2 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网