解答题-原理综合题 困难0.15 引用1 组卷390
1-丁烯是仅次于乙烯和丙烯的重要石油化工基本原料,可以利用正丁烷催化脱氢制备,催化脱氢又分为无氧催化脱氢和有氧催化脱氢。实际化工生产中需对反应条件(催化剂、温度等)进行探究,以获取最佳效益。
已知:I.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
II.产物收率=生成某产物的原料量/投入的原料量×100%。
(1)利用正丁烷无氧催化脱氢制备1-丁烯反应原理如下:
CH3CH2CH2CH3 H2C=CHCH2CH3+H2 ΔH
H2C=CHCH2CH3+H2 ΔH
已知CH3 CH2CH2CH3、CH2 =CHCH2CH3、H2的燃烧热分别为2 878 kJ/mol、2 720 kJ/mol、286 kJ/mol,计算ΔH=___________ 。
(2)无氧催化脱氢用Pt系催化剂时,正丁烷单位时间转化率和1-丁烯选择性如表所示。
①仅从1-丁烯选择性的角度考虑,应选择的催化剂为___________ (填催化剂序号,下同)。
②工业上,从1-丁烯单位时间收率的角度考虑,应选择的最佳催化剂为___________ 。
(3)其他条件相同,30 min时测得正丁烷转化率、1-丁烯收率随温度的变化关系如图所示。
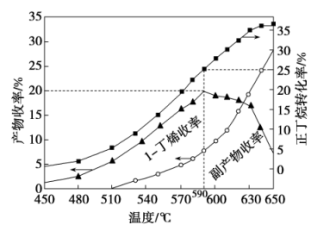
温度高于590 ℃时1-丁烯收率降低的原因是_________________ 。
(4)有氧催化脱氢通常选择O2或CO2为氧化剂,VOx-MgO为催化剂,反应原理如下:
2CH3CH2CH2CH3+O2 2CH2 =CHCH2CH3 +2H2O i
2CH2 =CHCH2CH3 +2H2O i
CH3 CH2CH2CH3+CO2 H2C=CHCH2CH3+H2O+CO ii
H2C=CHCH2CH3+H2O+CO ii
一定温度下,在体积为10 L的恒容密闭容器中,加入10 mol CH3CH2CH2CH3、7 mol O2、3 mol CO2进行反应i和ii.测得初始压强为20kPa,经过10h,反应达到平衡,此时压强变成25kPa,其中O2的体积分数为16%。回答下列问题:
①v(O2)=___________ kPa/h (用O2分压表示速率)。
②该温度下,反应ii的平衡常数Kp=___________ kPa。
③O2为氧化剂时,1-丁烯的选择性明显低于CO2为氧化剂时的选择性,分析可能原因:______________ 。
已知:I.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
II.产物收率=生成某产物的原料量/投入的原料量×100%。
(1)利用正丁烷无氧催化脱氢制备1-丁烯反应原理如下:
CH3CH2CH2CH3
已知CH3 CH2CH2CH3、CH2 =CHCH2CH3、H2的燃烧热分别为2 878 kJ/mol、2 720 kJ/mol、286 kJ/mol,计算ΔH=
(2)无氧催化脱氢用Pt系催化剂时,正丁烷单位时间转化率和1-丁烯选择性如表所示。
| 催化剂 | 单位时间转化率/% | 1-丁烯选择性/% |
| 催化剂1:PtSn/γ-Al2O3 | 23.0 | 92.0 |
| 催化剂2:PtSnSr0.2/γ-Al2O3 | 38.5 | 88.1 |
| 催化剂3:PtSn(0.3%)/MgAl2O4 | 27.0 | 98.9 |
②工业上,从1-丁烯单位时间收率的角度考虑,应选择的最佳催化剂为
(3)其他条件相同,30 min时测得正丁烷转化率、1-丁烯收率随温度的变化关系如图所示。

温度高于590 ℃时1-丁烯收率降低的原因是
(4)有氧催化脱氢通常选择O2或CO2为氧化剂,VOx-MgO为催化剂,反应原理如下:
2CH3CH2CH2CH3+O2
CH3 CH2CH2CH3+CO2
一定温度下,在体积为10 L的恒容密闭容器中,加入10 mol CH3CH2CH2CH3、7 mol O2、3 mol CO2进行反应i和ii.测得初始压强为20kPa,经过10h,反应达到平衡,此时压强变成25kPa,其中O2的体积分数为16%。回答下列问题:
①v(O2)=
②该温度下,反应ii的平衡常数Kp=
③O2为氧化剂时,1-丁烯的选择性明显低于CO2为氧化剂时的选择性,分析可能原因:
2023·山西晋中·三模
类题推荐
丁烯(C4H8)是重要的化工原料,可由丁烷(C4H10)催化脱氢制备,反应如下:CH3CH2CH2CH3(g) CH2=CHCH2CH3(g)+H2(g)ΔH
CH2=CHCH2CH3(g)+H2(g)ΔH
已知:
i.该工艺过程的副产物有炭(C),生成的积炭会附着在催化剂表面,影响催化效果。
ii.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
iii.H2(g)+ O2(g)=H2O(l) ΔH1
O2(g)=H2O(l) ΔH1
CH3CH2CH2CH3(g)+ O2(g)=4CO2(g)+5H2O(l) ΔH2
O2(g)=4CO2(g)+5H2O(l) ΔH2
CH2=CHCH2CH3(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH3
(1)用ΔH1、ΔH2、ΔH3表示丁烷催化脱氢反应的反应热ΔH=___ 。
(2)寻找高效的催化剂是脱氢反应重要的研究课题之一。
①催化剂使用一段时间后活性会下降,通入适量氢气可使其改善,氢气的作用是___ 。
②其他条件相同时,以SiO2为载体与不同质量百分比的CrOx组合,催化效果相关数据如表。
下列说法正确的是____ (填序号)。
a.脱氢反应中SiO2不起催化作用
b.CrOx的含量越高,反应的催化效果越好
c.CrOx的含量对丁烷脱氢反应的焓变无影响
(3)其他条件相同,30min时测得正丁烷转化率、正丁烯收率随温度的变化如图1。
[收率= ×100%]
×100%]
①实际生产温度选择590℃,由图1说明其理由是___ 。
②590℃时,向体积为1L的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成正丁烯的平均反应速率为__ mol/(L·min)。
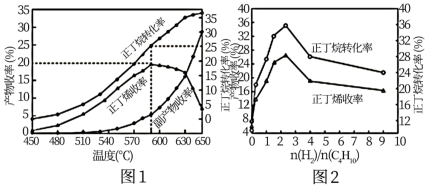
(4)其他条件相同,30min时正丁烷转化率、正丁烯收率随进料气中 的变化如图2。图2中,
的变化如图2。图2中, >2.5后,正丁烷转化率和正丁烯收率呈减小趋势,原因是
>2.5后,正丁烷转化率和正丁烯收率呈减小趋势,原因是___ 。
已知:
i.该工艺过程的副产物有炭(C),生成的积炭会附着在催化剂表面,影响催化效果。
ii.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
iii.H2(g)+
CH3CH2CH2CH3(g)+
CH2=CHCH2CH3(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH3
(1)用ΔH1、ΔH2、ΔH3表示丁烷催化脱氢反应的反应热ΔH=
(2)寻找高效的催化剂是脱氢反应重要的研究课题之一。
①催化剂使用一段时间后活性会下降,通入适量氢气可使其改善,氢气的作用是
②其他条件相同时,以SiO2为载体与不同质量百分比的CrOx组合,催化效果相关数据如表。
| 实验组 | 催化剂组成 | 正丁烷转化率/% | 正丁烯收率/% |
| 1 | 无催化剂 | 5 | 0.35 |
| 2 | SiO2 | 5 | 0.35 |
| 3 | SiO2+9%CrOx | 25.5 | 18.3 |
| 4 | SiO2+15%CrOx | 27.5 | 20.65 |
| 5 | SiO2+21%CrOx | 24 | 17.87 |
a.脱氢反应中SiO2不起催化作用
b.CrOx的含量越高,反应的催化效果越好
c.CrOx的含量对丁烷脱氢反应的焓变无影响
(3)其他条件相同,30min时测得正丁烷转化率、正丁烯收率随温度的变化如图1。
[收率=

①实际生产温度选择590℃,由图1说明其理由是
②590℃时,向体积为1L的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成正丁烯的平均反应速率为
(4)其他条件相同,30min时正丁烷转化率、正丁烯收率随进料气中
丁烯和丙烯都是重要的基础化工原料,工业上可用正丁烷制备1−丁烯,然后用1−丁烯制备丙烯。正丁烷催化脱氢制备1−丁烯的反应为:CH3CH2CH2CH3(g) CH2=CHCH2CH3(g)+H2(g) ΔH
CH2=CHCH2CH3(g)+H2(g) ΔH
已知:Ⅰ.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
Ⅱ.H2(g)、CH3CH2CH2CH3(g)、CH2=CHCH2CH3(g)的燃烧热分别为ΔH1=−Q1kJ•mol−1、ΔH2=−Q2kJ•mol−1、ΔH3=−Q3kJ•mol−1。
回答下列问题:
(1)ΔH=___________ 。(用含Q1、Q2、Q3的代数式表示)。
(2)其他条件相同时,在不同配比的催化剂条件下,催化效果的相关数据如表所示。
下列说法正确的是___________ (填标号)。
a.脱氢反应中SiO2不起催化作用
b.CrOx的含量越高,催化效果越好
c.CrOx的含量对脱氢反应的焓变无影响
(3)其他条件相同,30min时测得正丁烷转化率、1−丁烯收率(收率= ×100%)随温度的变化关系如图1所示。实际生产温度选择590℃,理由是
×100%)随温度的变化关系如图1所示。实际生产温度选择590℃,理由是___________ 。590℃时,向体积为1L的密闭容器中充入3mol正丁烷气体,据图1计算0~30min生成1−丁烯的平均反应速率为___________ mol/(L·min)。
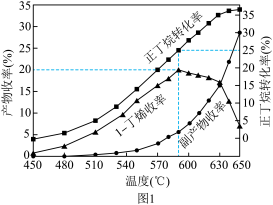
(4)在恒压密闭容器中投入等物质的量的1−丁烯和乙烯,某温度下制备丙烯,发生的反应为C4H8(g)+C2H4(g) 2C3H6(g),测得C3H6(g)的体积分数与时间的关系如图2所示。相对曲线d,曲线c仅改变一个条件,该条件可能是
2C3H6(g),测得C3H6(g)的体积分数与时间的关系如图2所示。相对曲线d,曲线c仅改变一个条件,该条件可能是___________ ,在该温度下,反应的平衡常数K=___________ 。
(5)Kolbe电解羧酸盐法可制取高纯度的烷烃。以Pt为电极,电解高浓度的丙酸钠(CH3CH2COONa)溶液可获得丁烷。装置如图3所示:
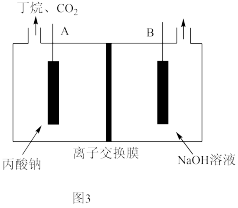
①该装置应选择___________ (填“阳”或“阴”)离子交换膜;
②A电极的电极反应式为___________ 。
已知:Ⅰ.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
Ⅱ.H2(g)、CH3CH2CH2CH3(g)、CH2=CHCH2CH3(g)的燃烧热分别为ΔH1=−Q1kJ•mol−1、ΔH2=−Q2kJ•mol−1、ΔH3=−Q3kJ•mol−1。
回答下列问题:
(1)ΔH=
(2)其他条件相同时,在不同配比的催化剂条件下,催化效果的相关数据如表所示。
| 实验组 | 催化剂组成 | 正丁烷转化率/% | 1−丁烯收率/% |
| 1 | 无催化剂 | 5 | 0.35 |
| 2 | SiO2 | 5 | 0.35 |
| 3 | SiO2+9%CrOx | 25.5 | 18.3 |
| 4 | SiO2+15%CrOx | 27.5 | 20.65 |
| 5 | SiO2+21%CrOx | 24 | 17.87 |
a.脱氢反应中SiO2不起催化作用
b.CrOx的含量越高,催化效果越好
c.CrOx的含量对脱氢反应的焓变无影响
(3)其他条件相同,30min时测得正丁烷转化率、1−丁烯收率(收率=

(4)在恒压密闭容器中投入等物质的量的1−丁烯和乙烯,某温度下制备丙烯,发生的反应为C4H8(g)+C2H4(g)

(5)Kolbe电解羧酸盐法可制取高纯度的烷烃。以Pt为电极,电解高浓度的丙酸钠(CH3CH2COONa)溶液可获得丁烷。装置如图3所示:

①该装置应选择
②A电极的电极反应式为
I.氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。回答下列问题:
(1)H2NCOONH4分解生成NH3与CO2气体的热化学方程式:H2NCOONH4(s) 2NH3(g)+CO2(g) ΔH=+159.5kJ/mol,恒容条件下,实验测得数据如下表所示:
2NH3(g)+CO2(g) ΔH=+159.5kJ/mol,恒容条件下,实验测得数据如下表所示:
①恒温恒容时,下列能够说明该反应已达到化学平衡状态的是___________ (填标号)。
A.容器内总压强不再改变 B.2v正(NH3)=v逆(CO2)
C.c2(NH3)∙c(CO2)的值不再改变 D.NH3的体积分数不再改变
②某温度下,该反应平衡时容器内总压强为p,写出该反应的压强平衡常数的计算式Kp=_______ (用平衡分压代替平衡浓度。分压=总压×物质的量分数)。
③随着温度升高,Kp逐渐_______ (填“增大”、“减小”或“不变”)。其主要原因是________ 。
④某温度下,达到平衡后,欲增加NH3的平衡浓度。可采取的措施有_______ (填标号)。
A.加H2NCOONH4 B.加催化剂 C.减小体积增大压强 D.移走CO2
(2)已知:RInKp= +C(C为常数)。
+C(C为常数)。
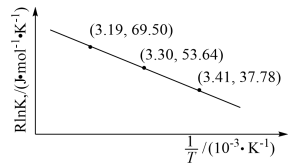
根据上表实验数据得到图象,则该反应的反应热ΔH=___________ kJ·mol-1。
II.内烯是重要的工业品。可用于制取卤代烃、内醇及塑料等。工业中以丙烷催化脱氢来制取丙烯:
主反应:C3H8(g) C3H6(g)+H2(g) ΔH1
C3H6(g)+H2(g) ΔH1
副反应:C3H8(g) CH4(g)+C2H4(g) ΔH2=+8130kJ·mol-1
CH4(g)+C2H4(g) ΔH2=+8130kJ·mol-1
已知部分化学键的键能如下表:
(3)△H1=___________ 。
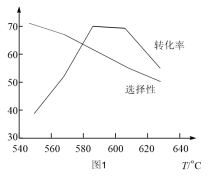
(4)不同温度下,丙烷以相同的流速经过装有催化剂的管道。测得丙烷转化率。丙烯选择性和温度的关系如图1所示。下列有关丙烷催化脱氢反应说法正确的是___________。
(5)某T℃时,在l0L密闭反应器中加入1mol丙烷进行催化脱氢实验,测得C3H6和C2H4的产率随时间的变化关系。如图2所示。
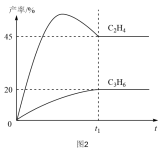
①t1前,相同时间内,C2H4的产率高于C3H6的原因是___________ 。
②T℃时,主反应的平衡常数K=___________ 。(保留2位有效数字)
(1)H2NCOONH4分解生成NH3与CO2气体的热化学方程式:H2NCOONH4(s)
| T/K | 293 | 298 | 303 | 308 | 313 |
| p/kPa | 8.60 | 11.40 | 16.24 | 20.86 | 30.66 |
①恒温恒容时,下列能够说明该反应已达到化学平衡状态的是
A.容器内总压强不再改变 B.2v正(NH3)=v逆(CO2)
C.c2(NH3)∙c(CO2)的值不再改变 D.NH3的体积分数不再改变
②某温度下,该反应平衡时容器内总压强为p,写出该反应的压强平衡常数的计算式Kp=
③随着温度升高,Kp逐渐
④某温度下,达到平衡后,欲增加NH3的平衡浓度。可采取的措施有
A.加H2NCOONH4 B.加催化剂 C.减小体积增大压强 D.移走CO2
(2)已知:RInKp=

根据上表实验数据得到图象,则该反应的反应热ΔH=
II.内烯是重要的工业品。可用于制取卤代烃、内醇及塑料等。工业中以丙烷催化脱氢来制取丙烯:
主反应:C3H8(g)
副反应:C3H8(g)
已知部分化学键的键能如下表:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能(kJ·mol-1) | 348 | 615 | 413 | 436 |
(4)不同温度下,丙烷以相同的流速经过装有催化剂的管道。测得丙烷转化率。丙烯选择性和温度的关系如图1所示。下列有关丙烷催化脱氢反应说法正确的是___________。

| A.主、副反应的ΔS相等 |
| B.温度升高,丙烯的产率增大 |
| C.单位时间内生成1molH-H键,同时消耗lmolC=C键,反应未达到平衡 |
| D.高于600°C,温度升高,主、副反应平衡逆移,导致丙烷转化率下降 |

①t1前,相同时间内,C2H4的产率高于C3H6的原因是
②T℃时,主反应的平衡常数K=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


