解答题-原理综合题 适中0.65 引用2 组卷52
党的二十大报告中指出:积极稳妥推进碳达峰碳中和,立足我国能源资源禀赋,坚持先立后破,有计划分步骤实施碳达峰行动。因此CO2的捕集和利用成了研究的重点。
(1)一种从空气中捕获CO2的转化原理如图所示。
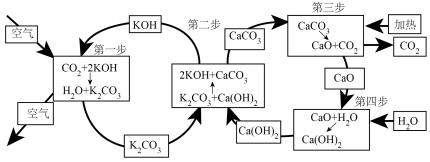
已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=_____ kJ•mol-1。(四步反应中相同物质的状态相同)
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
II.CO(g)+3H2(g) CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。
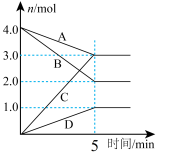
①图中表示两种组分的是曲线_____ (填标号),曲线B表示的物质为_____ (填化学式)。
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是_____ (填标号)。
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=_____ mol•L-1•min-1。反应I的平衡常数K=_____ 。
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为_____ (填“阴极”或“阳极”),写出b极上参加反应的CO2和H2O(物质的量比1:1)发生的电极反应:_____ 。

(1)一种从空气中捕获CO2的转化原理如图所示。

已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g)
II.CO(g)+3H2(g)
体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。

①图中表示两种组分的是曲线
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为

22-23高二下·广西·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网