解答题-结构与性质 较易0.85 引用1 组卷138
Fe、Ni和铜等过渡元素在生活中被广泛应用。回答下列问题:
(1)下列状态的铁中,电离最外层一个电子所需能量最大的是___________。
(2)在分析化学中 常用于
常用于 的掩蔽剂,因为生成的
的掩蔽剂,因为生成的 十分稳定,但
十分稳定,但 却不能与
却不能与 形成配合物,其原因是
形成配合物,其原因是___________ 。
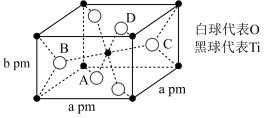
(3)基态Cu的价电子排布图为___________ ,位于___________ 区。元素 与
与 的第二电离能
的第二电离能 分别为
分别为 、
、 的原因是
的原因是___________ 。
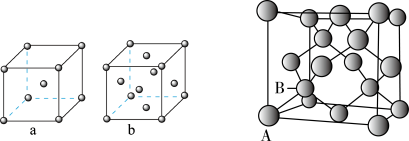
(4) 中各种微粒间的化学键有
中各种微粒间的化学键有___________  填序号
填序号 。
。
a.离子键 b.σ键 c.π键 d.配位键 e.氢键
1mol该物质中含有的σ键数为___________ 。其中与Cu2+配位更稳定的配体的分子构型为___________ 。
(5)镍和苯基硼酸在催化剂作用下可以合成丙烯醇 ,其相对分子质量等于丙醛
,其相对分子质量等于丙醛 ,但两者沸点相差较大,原因是
,但两者沸点相差较大,原因是___________ 。
(6)铁单质的堆积方式有两种,其剖面图分别如图a、 所示。
所示。
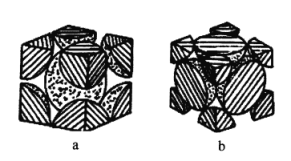
其中属于面心立方最密堆积的是___________ (填“ ”或“
”或“ ”),此晶体的空间利用率为
”),此晶体的空间利用率为___________  用含圆周率
用含圆周率 的代数式表示
的代数式表示
(1)下列状态的铁中,电离最外层一个电子所需能量最大的是___________。
| A. | B. | C. | D. |
(3)基态Cu的价电子排布图为
(4)
a.离子键 b.σ键 c.π键 d.配位键 e.氢键
1mol该物质中含有的σ键数为
(5)镍和苯基硼酸在催化剂作用下可以合成丙烯醇
(6)铁单质的堆积方式有两种,其剖面图分别如图a、

其中属于面心立方最密堆积的是
22-23高二下·四川成都·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网