解答题-原理综合题 困难0.15 引用1 组卷214
苯基硫醇(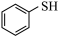 )又叫苯硫酚,是一种医药中间体,工业制备原理如下:
)又叫苯硫酚,是一种医药中间体,工业制备原理如下:
主反应: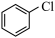 (g)+H2S(g)
(g)+H2S(g)
 (g)+HCl(g) ΔH=-16.8kJ ·mol-1
(g)+HCl(g) ΔH=-16.8kJ ·mol-1
副反应: (g)+H2S(g)
(g)+H2S(g)
 (g)+HCl(g)+
(g)+HCl(g)+ S8(g) ΔH =-45.8 kJ ·mol-1
S8(g) ΔH =-45.8 kJ ·mol-1
回答下列问题:
(1)一定温度下,相同时间内,苯基硫醇浓度增大的程度明显高于苯,其原因可能是主反应的活化能较___________ (填“大”或“小”)。
(2)T℃时,在容积为5L的恒容密闭容器中,充入物质的量均为2mol的氯苯和硫化氢,发生上述主反应和副反应,达到平衡时苯基硫醇的物质的量分数为25%,平衡时总压是初始总压的 倍。
倍。
①平衡时苯的浓度为___________ mol·L-1。
②主反应Kp=___________ (列出算式)。
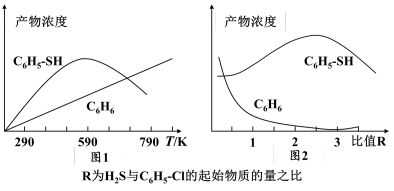
(3)恒容密闭容器中,在投料比 =1的条件下,测得苯基硫醇和苯的收率(
=1的条件下,测得苯基硫醇和苯的收率( )在相同时间内随温度的变化如下图所示:
)在相同时间内随温度的变化如下图所示:
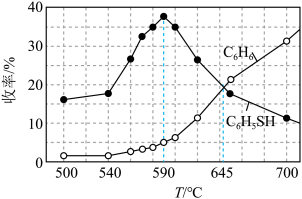
①温度小于590℃,苯基硫醇的收率随温度升高而增大的可能原因是___________ 。
②590℃时,副反应未达到平衡,理由是___________ 。
③645℃时,H2S中硫原子的物质的量是S8中硫原子的物质的量___________ 倍。
(4)反应 (g)
(g) 
 (g) +
(g) + S8(g)的ΔH =
S8(g)的ΔH =___________ kJ ·mol-1,恒温恒容条件下,该分解反应达到平衡时,增大反应物苯基硫醇的浓度,再次达到平衡后,苯基硫醇的转化率___________ (填“增大”“减小”或“不变”)。
 )又叫苯硫酚,是一种医药中间体,工业制备原理如下:
)又叫苯硫酚,是一种医药中间体,工业制备原理如下:主反应:
 (g)+H2S(g)
(g)+H2S(g) (g)+HCl(g) ΔH=-16.8kJ ·mol-1
(g)+HCl(g) ΔH=-16.8kJ ·mol-1副反应:
 (g)+H2S(g)
(g)+H2S(g) (g)+HCl(g)+
(g)+HCl(g)+回答下列问题:
(1)一定温度下,相同时间内,苯基硫醇浓度增大的程度明显高于苯,其原因可能是主反应的活化能较
(2)T℃时,在容积为5L的恒容密闭容器中,充入物质的量均为2mol的氯苯和硫化氢,发生上述主反应和副反应,达到平衡时苯基硫醇的物质的量分数为25%,平衡时总压是初始总压的
①平衡时苯的浓度为
②主反应Kp=
(3)恒容密闭容器中,在投料比

①温度小于590℃,苯基硫醇的收率随温度升高而增大的可能原因是
②590℃时,副反应未达到平衡,理由是
③645℃时,H2S中硫原子的物质的量是S8中硫原子的物质的量
(4)反应
 (g)
(g)  (g) +
(g) +2023·山西大同·三模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网