解答题-实验探究题 较难0.4 引用2 组卷161
光催化技术是指利用半导体材料在光照条件下激发产生强氧化性物质,将空气中的污染物分解为CO2、H2O等小分子,Bi2MoO6对可见光有较强的响应,在光催化领域具有稳定高效的催化效果,其制备方法如下:
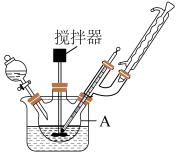
(一)微球状前驱体BiOI的制备
I.向反应仪器A中加入无水乙醇,并加入agBi(NO3)3·5H2O固体和足量KI固体,常温下搅拌30min至溶解完全。
Ⅱ.由分液漏斗滴加氨水调节溶液pH为7后,将反应装置放入油浴中,在80℃下回流3h。
Ⅲ.抽滤收集反应后的砖红色沉淀,经洗涤、干燥后研磨备用。
(二)Bi2MoO6的制备
Ⅳ.将上述制备得到的BiOI,足量Na2MoO4·2H2O和去离子水加入反应釜中,调节体系pH为7后,将反应釜密封好,于150℃下反应24h,自然冷却到室温,抽滤所得沉淀,经洗涤、干燥后得最终产物bg。
已知:①Bi(OH)3的Ksp为6.0×10-31;②Bi(NO3)3·5H2O和KI均可溶于乙醇;③Bi(NO3)3·5H2O的摩尔质量为485g·mol-1,Bi2MoO6的摩尔质量为610g·mol-1。
回答下列问题:
(1)制备BiOI的反应仪器A的名称是___________ 。
(2)I中不选择水作溶剂的主要原因是___________ 。
(3)Ⅱ中加入氨水后,发生反应的离子方程式为___________ 。
(4)Ⅱ中反应需在中性环境下进行。
①不可呈酸性的主要原因是___________ ,
②不可呈碱性的主要原因是___________ 。
(5)Ⅳ中反应的离子方程式为___________ 。
(6)Bi2MoO6的产率为___________ ×100%(用含a,b的代数式表示)。

(一)微球状前驱体BiOI的制备
I.向反应仪器A中加入无水乙醇,并加入agBi(NO3)3·5H2O固体和足量KI固体,常温下搅拌30min至溶解完全。
Ⅱ.由分液漏斗滴加氨水调节溶液pH为7后,将反应装置放入油浴中,在80℃下回流3h。
Ⅲ.抽滤收集反应后的砖红色沉淀,经洗涤、干燥后研磨备用。
(二)Bi2MoO6的制备
Ⅳ.将上述制备得到的BiOI,足量Na2MoO4·2H2O和去离子水加入反应釜中,调节体系pH为7后,将反应釜密封好,于150℃下反应24h,自然冷却到室温,抽滤所得沉淀,经洗涤、干燥后得最终产物bg。
已知:①Bi(OH)3的Ksp为6.0×10-31;②Bi(NO3)3·5H2O和KI均可溶于乙醇;③Bi(NO3)3·5H2O的摩尔质量为485g·mol-1,Bi2MoO6的摩尔质量为610g·mol-1。
回答下列问题:
(1)制备BiOI的反应仪器A的名称是
(2)I中不选择水作溶剂的主要原因是
(3)Ⅱ中加入氨水后,发生反应的离子方程式为
(4)Ⅱ中反应需在中性环境下进行。
①不可呈酸性的主要原因是
②不可呈碱性的主要原因是
(5)Ⅳ中反应的离子方程式为
(6)Bi2MoO6的产率为
2023·湖北·二模
类题推荐
重铬酸钾( )是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为
)是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为 ,含
,含 、
、 等杂质)为原料制备重铬酸钾,并进行性质验证实验。
等杂质)为原料制备重铬酸钾,并进行性质验证实验。
已知:相关物质在不同温度时的溶解度/g如下表:
实验一:重铬酸钾的制备
步骤Ⅰ:将一定量NaOH和 的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与
的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与 继续加热50分钟,发生反应:
继续加热50分钟,发生反应: ,自然冷却。
,自然冷却。
步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去 和
和 ,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是_____ (填仪器名称)。

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是_______ ,过滤前先加热的目的是________ 。
(3)步骤Ⅳ中的结晶方法是_______ (填“蒸发结晶”或“冷却结晶”),有同学制得的重铬酸钾晶体颜色偏黄,可能的原因是_______ 。
实验二:用重铬酸钾测定 固体试样中铁的含量
固体试样中铁的含量
已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g 固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL
固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL 溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式________ 。
②测定 固体试样中铁的质量分数为
固体试样中铁的质量分数为_____ (保留两位小数)。
③测定结果偏大的可能原因是_______ 。
已知:相关物质在不同温度时的溶解度/g如下表:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| 重铬酸钾 | 4.7 | 12.3 | 26.3 | 45.6 | 73 |
| 重铬酸钠 | 163 | 183 | 215 | 269 | 76 |
步骤Ⅰ:将一定量NaOH和
步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去
步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得
回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是
(3)步骤Ⅳ中的结晶方法是
实验二:用重铬酸钾测定
已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g
①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式
②测定
③测定结果偏大的可能原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网