解答题-原理综合题 较易0.85 引用1 组卷95
在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化和反应速率,合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请回答下列问题:
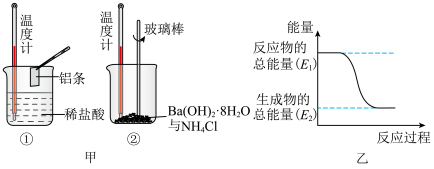
(1)分析如图的能量变化,则 为
为___________ (填“吸热”或“放热”)反应。下列化学反应的能量变化与 的能量变化相同的是
的能量变化相同的是___________ (填标号)。
A.稀硫酸与 溶液的反应 B.点燃的镁条在氮气中继续燃烧
溶液的反应 B.点燃的镁条在氮气中继续燃烧
C.灼热的炭与二氧化碳的反应 D. 与
与 的反应
的反应
(2)断裂 键、
键、 键、
键、 键分别需要的能量是
键分别需要的能量是 、
、 、
、 ,则生成
,则生成 放出的热量为
放出的热量为___________  。
。
(3)如如图是某同学设计的一个简易原电池装置。请回答下列问题。
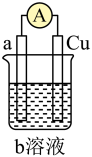
①若a电极材料为碳、b溶液为 溶液,则正极的电极反应式为
溶液,则正极的电极反应式为___________ ,当有1.6g负极材料溶解时,转移的电子个数为___________ 。
②若a电极材料为铁,b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为___________ →___________ (填电极材料,下同),溶液中的 向
向___________ 极移动。
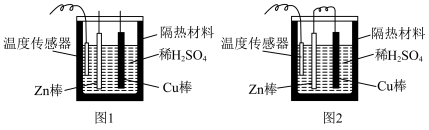
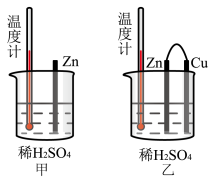
(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是___________(填字母)。
(5)向某体积固定的密闭容器中加入 、
、 和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
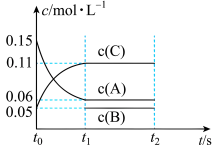
①若 ,则
,则 内反应速率
内反应速率
___________ ;
②写出反应的化学方程式:___________ 。
(1)分析如图的能量变化,则

A.稀硫酸与
C.灼热的炭与二氧化碳的反应 D.
(2)断裂
(3)如如图是某同学设计的一个简易原电池装置。请回答下列问题。

①若a电极材料为碳、b溶液为
②若a电极材料为铁,b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为
(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是___________(填字母)。

| A.图甲和图乙的气泡均产生于锌棒表面 | B.图乙中产生气体的速率比图甲快 |
| C.图甲中温度计的示数高于图乙的示数 | D.图甲和图乙中温度计的示数相等,且均高于室温 |

①若
②写出反应的化学方程式:
22-23高一下·山东泰安·期中
类题推荐
能源是现代文明的原动力,通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。2SO2(g)+O2(g) 2SO3(g) ΔH=akJ·mol-1,反应过程的能量变化如图所示,已知1molSO2(g)完全转化为lmolSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ·mol-1,反应过程的能量变化如图所示,已知1molSO2(g)完全转化为lmolSO3(g)放热99kJ。请回答:

(1)a=_______ kJ·mol-1。
(2)Ea的大小对该反应的ΔH_______ (填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_______ (填“升高”、“降低”或“不变”)。
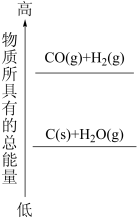
(3)由盖斯定律结合下述反应方程式,回答问题:
已知:①C(s)+O2(g)=CO2(g) ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)
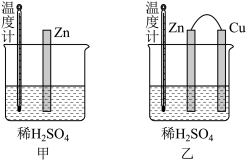
(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是_______(填字母)。
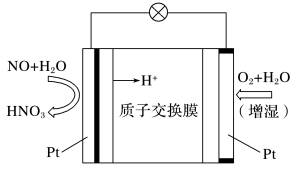
(5)一氧化氮—空气质子交换膜燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示,写出放电过程中负极的电极反应式:_______ ,若过程中产生2 mol HNO3,则消耗标准状况下O2的体积为_______ L。
(6)向某体积固定的密闭容器中加入0.3 A、0.1
A、0.1 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
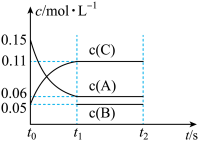
①若t1=15,则t0-t1内反应速率v(C)=_______ ;
②写出反应的化学方程式:_______ 。
(7)已知NO2(g)与SO2(g)发生可逆反应:NO2(g)+SO2(g) SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是
SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是_______ 。
a.只要经过足够长的时间,可使c(SO2)=0
b.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
c.达到平衡状态时,各物质的物质的量浓度相等
d.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化

(1)a=
(2)Ea的大小对该反应的ΔH
(3)由盖斯定律结合下述反应方程式,回答问题:
已知:①C(s)+O2(g)=CO2(g) ΔH1;
②2CO(g)+O2(g)=2CO2(g) ΔH2;
③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3;
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(4)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是_______(填字母)。

| A.图甲和图乙的气泡均产生于锌棒表面 |
| B.图乙中产生气体的速率比图甲快 |
| C.图甲中温度计的示数高于图乙的示数 |
| D.图甲和图乙中温度计的示数相等,且均高于室温 |

(6)向某体积固定的密闭容器中加入0.3

①若t1=15,则t0-t1内反应速率v(C)=
②写出反应的化学方程式:
(7)已知NO2(g)与SO2(g)发生可逆反应:NO2(g)+SO2(g)
a.只要经过足够长的时间,可使c(SO2)=0
b.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
c.达到平衡状态时,各物质的物质的量浓度相等
d.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请回答下列问题:
(1)一种蓄电池在充电和放电时发生的反应是 。则该电池放电时发生还原反应的物质是_______(填标号)。
。则该电池放电时发生还原反应的物质是_______(填标号)。
(2)科学家制造出了一种使用固体电解质的燃料电池,其效率很高,可用于航天航空。如图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入 和空气,其中固体电解质是掺杂了
和空气,其中固体电解质是掺杂了 的
的 固体,它在高温下能传导O2-。则c电极的名称为
固体,它在高温下能传导O2-。则c电极的名称为_______ (填“正极”或“负极”),d电极上的电极反应式为_______ 。
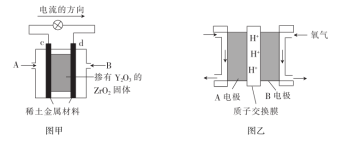
(3)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图乙所示。H+的移动方向为由_______ (填“A”或“B”,下同)电极到_______ 电极。写出B电极的电极反应式:_______ 。
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为 。
。
①放电时,正极发生_______ (填“氧化”或“还原”)反应。已知负极的电极反应式为 ,则正极的电极反应式为
,则正极的电极反应式为_______ 。
②放电时,_______ (填“正”或“负”)极附近溶液的碱性增强。
(1)一种蓄电池在充电和放电时发生的反应是
| A. | B. | C. | D. |

(3)绿色电源“直接二甲醚(CH3OCH3)燃料电池”的工作原理如图乙所示。H+的移动方向为由
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为
①放电时,正极发生
②放电时,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网