填空题 适中0.65 引用1 组卷104
钾和碘的相关化合物在化工、医药、材料等领域有广泛应用。回答下列问题:
(1)含有K元素的盐的焰色试验呈紫色:
①基态K原子的核外电子排布式为______ 。
②基态K原子中,其核外电子占据最高能层的电子云轮廓图形状为_____ ,成对电子数与未成对电子数之比为______ 。
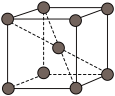
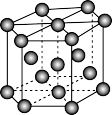
③钾晶体的结构模型如图,该晶体中存在的作用力为______ 。
(2)常温下,在一小试管中放入一小粒碘晶体(紫黑色),加入约5mL蒸馏水,观察到试管底部有少量紫黑色难溶物;将上层液体倾倒于另一试管中,加入约1mL四氯化碳(CCl4),振荡试管,观察到碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管中加入0.5mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,发生的反应为I2+I- I
I 。
。
①CCl4属于_____ (填“极性”或“非极性”)分子。
②CCl4分子之间存在的作用力为_____ (填“氢键”或“范德华力”。
③大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π 。已知I
。已知I 中存在大π键,其可表示为
中存在大π键,其可表示为_____ 。
④X射线衍射线测定发现,I3AsF6中存在I 。0.5molI
。0.5molI 中的中心原子价(层)电子对数为
中的中心原子价(层)电子对数为_____ NA。(设NA为阿伏加德罗常数的值)
(1)含有K元素的盐的焰色试验呈紫色:
①基态K原子的核外电子排布式为
②基态K原子中,其核外电子占据最高能层的电子云轮廓图形状为

③钾晶体的结构模型如图,该晶体中存在的作用力为
(2)常温下,在一小试管中放入一小粒碘晶体(紫黑色),加入约5mL蒸馏水,观察到试管底部有少量紫黑色难溶物;将上层液体倾倒于另一试管中,加入约1mL四氯化碳(CCl4),振荡试管,观察到碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管中加入0.5mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,发生的反应为I2+I-
①CCl4属于
②CCl4分子之间存在的作用力为
③大π键可用符号Π
④X射线衍射线测定发现,I3AsF6中存在I
22-23高二下·福建龙岩·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网