计算题 较易0.85 引用1 组卷412
按要求回答下列问题:
(1)25 ℃时,Kb(NH3·H2O)=1.8×10−5;H2SO3:Ka1=1.5×10−2,Ka2=1.0×10−7;Ksp(CaSO4)=7.1×10−5
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应:Ca2++2OH-+2 +
+
 CaSO4↓+2NH3·H2O K
CaSO4↓+2NH3·H2O K
①25 ℃时,0.1 mol∙L−1 (NH4)2SO3溶液的pH___________ (填“>”“<”或“=”)7
②计算第2步中反应的K=___________
(2)“亚硫酸盐法”吸收烟气中的SO2
①将烟气通入1.0 mol∙L−1的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断___________ (填“减小”“不变”或“增大”)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c( )=0.2 mol∙L−1,则溶液中c(
)=0.2 mol∙L−1,则溶液中c( )=
)=___________
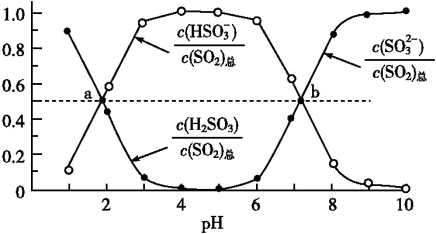
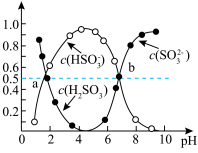
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图。b点时溶液pH=7,则n( )∶n(
)∶n( )=
)=___________
(3)常温下,H2CO3的电离常数为Ka1=4×10−7,Ka2=4×10−11。已知0.1 mol∙L−1 NH4HCO3溶液的pH=8,则在此溶液中:
①下列有关离子浓度的关系式中,不正确的是___________
A.c( )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.c( )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c( )+c(H2CO3)
)+c(H2CO3)
C.c(H2CO3) −c( )−c(NH3·H2O)=9.9×10-7 mol∙L−1
)−c(NH3·H2O)=9.9×10-7 mol∙L−1
② =
=___________
(1)25 ℃时,Kb(NH3·H2O)=1.8×10−5;H2SO3:Ka1=1.5×10−2,Ka2=1.0×10−7;Ksp(CaSO4)=7.1×10−5
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应:Ca2++2OH-+2
①25 ℃时,0.1 mol∙L−1 (NH4)2SO3溶液的pH
②计算第2步中反应的K=
(2)“亚硫酸盐法”吸收烟气中的SO2
①将烟气通入1.0 mol∙L−1的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图。b点时溶液pH=7,则n(

(3)常温下,H2CO3的电离常数为Ka1=4×10−7,Ka2=4×10−11。已知0.1 mol∙L−1 NH4HCO3溶液的pH=8,则在此溶液中:
①下列有关离子浓度的关系式中,不正确的是
A.c(
B.c(
C.c(H2CO3) −c(
②
2023高三·全国·专题练习
类题推荐
按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是______ 。
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍,pH与②相同
C.①与③混合,若溶液pH=7,则溶液中c(NH )>c(Cl-)
)>c(Cl-)
D.②与④等体积混合,混合溶液的pH>7
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=______ mol·L−1。将SO2通入该氨水中,当c(OH−)降至1.0×10−7mol·L−1时,溶液中的 =
=______ 。
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。
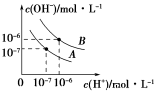
①曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______ α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH______ 7。
②在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=______ 。
③若另一温度下测得0.01 mol·L-1的NaOH溶液的pH为11。在该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=______ 。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=______ 。
(1)常温下,有关下列四种溶液的说法正确的是
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍,pH与②相同
C.①与③混合,若溶液pH=7,则溶液中c(NH
D.②与④等体积混合,混合溶液的pH>7
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。

①曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1
②在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=
③若另一温度下测得0.01 mol·L-1的NaOH溶液的pH为11。在该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是___________。
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=___________ mol·L−1。将SO2通入该氨水中,当c(OH−)降至1.0×10−7mol·L−1时,溶液中的 =
=___________ 。
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。
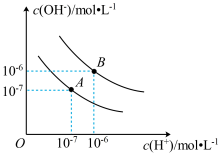
①曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1___________ α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH___________ 7。
②在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=___________ 。
③若另一温度下测得0.01 mol·L-1的NaOH溶液的pH为11。在该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=___________ 。
(1)常温下,有关下列四种溶液的说法正确的是___________。
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
| C.①与③混合,若溶液pH=7,则溶液中c(NH |
| D.②与④等体积混合,混合溶液的pH>7 |
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。

①曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1
②在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=
③若另一温度下测得0.01 mol·L-1的NaOH溶液的pH为11。在该温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网