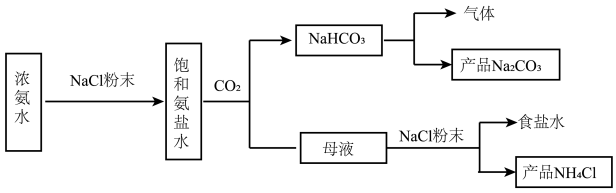
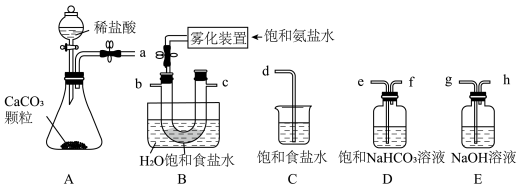
解答题-实验探究题 适中0.65 引用1 组卷76
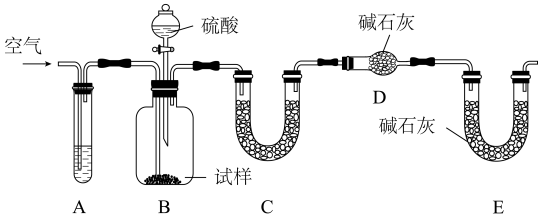
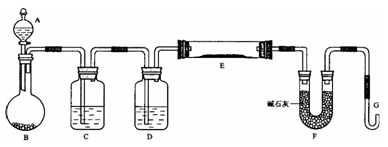
测定铜的相对原子质量。氨气是一种无色、有强烈的刺激气味的气体。氨气具有还原性,可以与灼热的氧化铜反应可得到氮气和金属铜。某课外小组利用该反应和下列装置测定Cu的相对原子质量。

(1)按正确的顺序连接上述实验装置:___________ 。
(2)在使用石英管进行加热时,需要对通入石英管的气体进行干燥,否则在较高的温度下,若气体不纯则有可能引起装置炸裂。D装置为U形干燥管,其目的就是干燥氨气,防止通入C中引起石英管破裂。B中可选用的干燥剂是
(3)C试管被用于制备反应所需要的氨气,其中盛装的是足量的氯化铵和氢氧化钙的混合物。C中的反应的化学方程式为___________ 。
(4)B中观察到的现象是___________ ,实验时,E中收集到的物质是___________ 。
(5)为准确测定铜的相对原子质量,课外小组正确组建装置进行实验,并在实验中测得如下数据:
①实验前,称量空B管的质量为ag:
②在B管中装入药品,称得B管和CuO样品的总质量为bg:
③待充分加热后,撤去酒精灯,使B管和Cu粉冷却到室温,再称量其总质量为cg。
根据以上数据,列出计算Cu的相对原子质量的计算式: =
=___________ 。(用含字母的代数式表示)

(1)按正确的顺序连接上述实验装置:
(2)在使用石英管进行加热时,需要对通入石英管的气体进行干燥,否则在较高的温度下,若气体不纯则有可能引起装置炸裂。D装置为U形干燥管,其目的就是干燥氨气,防止通入C中引起石英管破裂。B中可选用的干燥剂是
| A.浓硫酸 | B.无水 | C.无水硫酸铜 | D.碱石灰 |
(4)B中观察到的现象是
(5)为准确测定铜的相对原子质量,课外小组正确组建装置进行实验,并在实验中测得如下数据:
①实验前,称量空B管的质量为ag:
②在B管中装入药品,称得B管和CuO样品的总质量为bg:
③待充分加热后,撤去酒精灯,使B管和Cu粉冷却到室温,再称量其总质量为cg。
根据以上数据,列出计算Cu的相对原子质量的计算式:
22-23高二下·上海普陀·期中
类题推荐
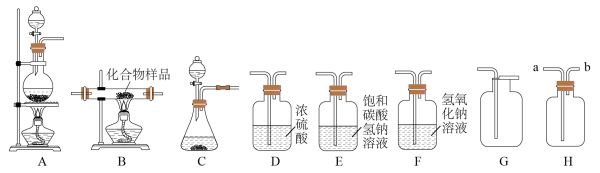
如图所示为实验室中常见气体制备、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),化学小组的同学利用其进行下列化学实验。
请回答下列问题:
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集干燥的二氧化碳气体,并除去其中的HCl,按要求设计实验装置,连接仪器,检查装置的气密性,并进行实验。(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为___________ (从左到右填写仪器序号字母)。
②上述制二氧化碳的化学方程式为___________ 。
③下列有关CO2制取和性质的叙述中,不正确的是___________ (填标号)。
a.实验室制CO2时,应先检查装置的气密性,再加入药品
b.能使燃着的木条熄灭的气体一定是CO2
c.将CO2通入紫色石蕊试液中,石蕊试液变红色
d.将燃着的木条置于集气瓶口熄灭,证明CO2已收集满
(2)用一氧化碳气体(含有少量二氧化碳和水蒸气)测定某铁的氧化物(FexOy)试样的元素组成比例,所选装置按“混合气体→D1→B→F→D2”的顺序连接(D1、D2为浓硫酸洗气瓶,实验前检查装置的气密性,假设所发生的化学反应都充分反应)。进行实验并记录实验数据,如下表所示:
①请选择合理数据计算FexOy中氧元素的质量为___________ g,x:y=___________ (填最简整数比)。
②从环保角度考虑,该实验方案设计还存在不完善之处,你的具体改进方案是___________ 。
(3)已知氯气(Cl2)在常温、常压下是一种黄绿色气体;有强烈的刺激性气味,吸入少量氯气就会使鼻腔和喉头粘膜受到刺激并引起胸痛和咳嗽;氯气密度比空气大,可溶于水;是一种化学性质非常活泼的非金属单质。实验室中可采用浓盐酸与二氧化锰在加热的条件下制取氯气,同时生成氯化锰(MnCl2)和水。根据上述信息,请回答下列问题:
①请写出上述方法制取氯气的化学方程式:___________ 。
②在实验室中制取氯气选用的发生装置为___________ (填仪器序号字母),若用装置H收集氯气,气体应从导管___________ (选填“a”“b”之一)口进入集气瓶。
③实验室制取氯气时常用NaOH溶液吸收尾气。氯气通入氢氧化钠溶液中可以得到氯化钠、次氯酸钠(NaClO)和水,该反应的化学方程式为___________ 。

请回答下列问题:
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集干燥的二氧化碳气体,并除去其中的HCl,按要求设计实验装置,连接仪器,检查装置的气密性,并进行实验。(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为
②上述制二氧化碳的化学方程式为
③下列有关CO2制取和性质的叙述中,不正确的是
a.实验室制CO2时,应先检查装置的气密性,再加入药品
b.能使燃着的木条熄灭的气体一定是CO2
c.将CO2通入紫色石蕊试液中,石蕊试液变红色
d.将燃着的木条置于集气瓶口熄灭,证明CO2已收集满
(2)用一氧化碳气体(含有少量二氧化碳和水蒸气)测定某铁的氧化物(FexOy)试样的元素组成比例,所选装置按“混合气体→D1→B→F→D2”的顺序连接(D1、D2为浓硫酸洗气瓶,实验前检查装置的气密性,假设所发生的化学反应都充分反应)。进行实验并记录实验数据,如下表所示:
| 装置编号 | D1中浓硫酸 | B中玻璃管内固体 | F中溶液 |
| 反应前质量 | 150g | 14.4g | 200g |
| 反应后质量 | 152.7g | 11.2g | 213.2g |
②从环保角度考虑,该实验方案设计还存在不完善之处,你的具体改进方案是
(3)已知氯气(Cl2)在常温、常压下是一种黄绿色气体;有强烈的刺激性气味,吸入少量氯气就会使鼻腔和喉头粘膜受到刺激并引起胸痛和咳嗽;氯气密度比空气大,可溶于水;是一种化学性质非常活泼的非金属单质。实验室中可采用浓盐酸与二氧化锰在加热的条件下制取氯气,同时生成氯化锰(MnCl2)和水。根据上述信息,请回答下列问题:
①请写出上述方法制取氯气的化学方程式:
②在实验室中制取氯气选用的发生装置为
③实验室制取氯气时常用NaOH溶液吸收尾气。氯气通入氢氧化钠溶液中可以得到氯化钠、次氯酸钠(NaClO)和水,该反应的化学方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网