解答题-原理综合题 适中0.65 引用1 组卷89
甲醇是一种高效清洁的新能源,已知在常温常压下:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH1=-184.0kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH2=-572.0kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式_______ 。
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是_______ (填字母)。
a.容器中气体的压强不变
b.CO 和CH3OH 浓度相等
c.υ消耗(CH3OH)=υ生成(CO)
d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是_______ (填字母)。
a.减小容器容积
b.升高温度
c.向装置中再充入He
d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。
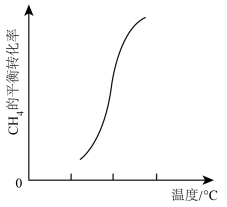
则ΔH2_______ 0(填“<”、“>”或“=”),在T℃时的10L密闭容器中,充入2molCH4和3molH2O(g)发生反应②,经过5min达到平衡,此时CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为_______ 。若向此10L密闭容器中,加入2molCH4、5molH2O(g)、2molCO、和3molH2发生反应②,若温度仍为T℃,此时υ(正)_______ υ(逆)(填“<”、“>”或“=”)。
(5)若某温度下,将2molCH4(g)和2molH2O(g)充入到压强为200kPa的恒压密闭容器中发生反应②,平衡时CH4消耗50%时,求该温度下的分压平衡常数KP=_______ kPa2(分压=总压×物质的量分数)
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH1=-184.0kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH2=-572.0kJ/mol
(1)则表示CH3OH(l)燃烧热的热化学方程式
在恒温恒容的密闭容器中,工业上常用反应①:CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0制备甲醇;其中的原料气常用反应②:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH2来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是
a.容器中气体的压强不变
b.CO 和CH3OH 浓度相等
c.υ消耗(CH3OH)=υ生成(CO)
d.容器中混合气体的密度保持不变
e.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是
a.减小容器容积
b.升高温度
c.向装置中再充入He
d.向装置中再充入H2
(4)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示。

则ΔH2
(5)若某温度下,将2molCH4(g)和2molH2O(g)充入到压强为200kPa的恒压密闭容器中发生反应②,平衡时CH4消耗50%时,求该温度下的分压平衡常数KP=
22-23高二下·湖南衡阳·阶段练习
类题推荐
甲醇、二甲醚(CH3OCH3)是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为___________ mol·L-1·min-1。
(2)由表中数据判断ΔH1___________ (填“>”“<”或“=”)0;反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=
CO(g)+H2O(g) ΔH3=___________ (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是___________ (填序号)。
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)T1K时,将1mol CH3OCH3引入一个抽真空的150L恒容密闭容器中,发生分解反应:CH3OCH3(g) CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表,
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表,
①反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___________ 反应(填“放热”或“吸热”)。由表中数据计算,反应达平衡时,二甲醚的分解率为___________ ,该温度下平衡常数Kc=___________ 。
②在T2K、1.0X104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g) +CH4(g) = CH3CHO(g),反应速率 ,
, 、
、 分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总X体积分数)。用气体分压表示的平衡常数Kp = 4.5×10-5 (kPa)-1,则CO的转化率为20%时,
分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总X体积分数)。用气体分压表示的平衡常数Kp = 4.5×10-5 (kPa)-1,则CO的转化率为20%时,
___________ 。
反应Ⅰ:CO(g)+2H2(g)
反应Ⅱ:CO2(g)+3H2(g)
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| KⅠ | 2.0 | 0.27 | 0.012 |
(2)由表中数据判断ΔH1
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)T1K时,将1mol CH3OCH3引入一个抽真空的150L恒容密闭容器中,发生分解反应:CH3OCH3(g)
 CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表,
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表,| 反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
| 气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
②在T2K、1.0X104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g) +CH4(g) = CH3CHO(g),反应速率
甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______ 。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______ 。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正_______ v逆(填“>”“=”或“<”)。
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为_______ 。
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______ ,乙中CO2的转化率_______ (填“大于”、“等于”或“小于”)甲。
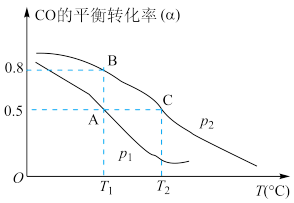
(6)在CO合成甲醇过程中,将10molCO与20molH2充入一容积可变的密闭容器中,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。下列说法正确的是_______(填字母)。
(7)工业上可利用CO或CO2来生产甲醇可能会产生积碳现象。如图表示不同温度条件下,反应Ⅰ: 发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
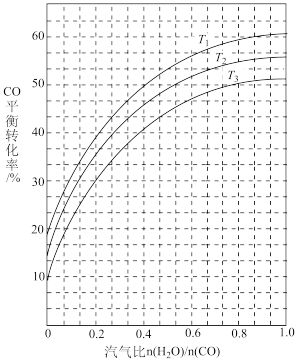
①判断 和
和 由大到小的关系为
由大到小的关系为_______ ;
②若经反应I发生后的汽气比为0.8,所得混合气体经反应II后,得到CO与H2的物质的量之比为 ,则反应II:
,则反应II: 应选择的温度是
应选择的温度是_______ (填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
| 化学反应 | 平衡常数 | 温度/ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g) | K3 | ||
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为
| 起始浓度 | 甲 | 乙 |
| c(H2)/mol/L | 0.10 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.20 |
(6)在CO合成甲醇过程中,将10molCO与20molH2充入一容积可变的密闭容器中,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。下列说法正确的是_______(填字母)。

| A.合成甲醇的反应为吸热反应 |
| B.压强为p1>p2 |
| C.A、B、C三点的平衡常数为KA=KB>KC |
| D.若达平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积也为10L |

①判断
②若经反应I发生后的汽气比为0.8,所得混合气体经反应II后,得到CO与H2的物质的量之比为
在工业上,常用CO和H2合成甲醇,其相关的反应原理方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知:①CO(g)+ O2(g)= CO2(g) △H1= a kJ/mol
O2(g)= CO2(g) △H1= a kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2= b kJ/mol
O2(g)=H2O(g) △H2= b kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
回答下列问题:
(1)△H=___________ kJ/mol 。
(2)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。

①当起始 =2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)
=2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)___________ 。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将___________ (选填“增大”、“减小”或“不变”);
②当起始 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“D”、“E”或“F”) 。
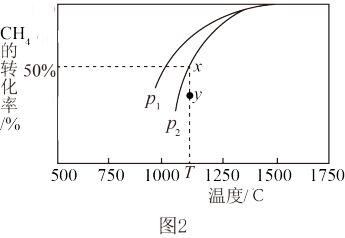
(4)已知CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1___________ P2(选填“>” “<” 或“=”);当压强为P2时,在y点:v(正)___________ v(逆)(选填“大于”、“小于”或“等于”)。若P2=3MPa且在恒压体系中发生,则T℃时该反应的平衡常数Kp = ___________ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
已知:①CO(g)+
②H2(g)+
③CH3OH(g)+
回答下列问题:
(1)△H=
(2)能说明反应CO(g)+2H2(g)
| A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |

①当起始
②当起始
(4)已知CO2(g)+CH4(g)

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


