解答题-原理综合题 适中0.65 引用1 组卷190
丙烯(C3H6)是重要的基础化工原料,可采用PDH法、ODHP法、电解法等制备。
(1)PDH法的反应原理为C3H8(g)⇌C3H6(g)+H2(g),该反应的ΔH=+115.4kJ·mol-1。
①已知H2(g)、C3H8(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-2219.9kJ·mol-1,则表示C3H6(g)的燃烧热的热化学方程式为___________ 。
②已知PDH反应在550℃以上才能自发进行,但温度太高容易导致C-C键断裂。一定时间内(未达到平衡),下列措施一定能提高C3H6产率的是___________ (填字母)。
A.选择合适的催化剂 B.升高温度 C.减小压强
③某温度下,向恒容密闭容器中充入C3H8使其仅发生PDH反应,已知起始压强为5kPa,经20min达到平衡,平衡时总压为起始时的1.8倍。若用单位时间内气体分压的变化来表示反应速率,即v= ,则0~20min内的平均反应速率v(C3H8)=
,则0~20min内的平均反应速率v(C3H8)=___________ kPa·min-1;若用平衡分压代替平衡浓度,则该温度下PDH反应的平衡常数Kp=___________ kPa。
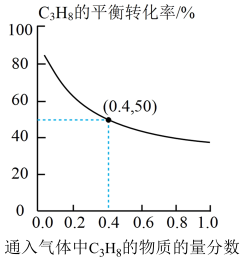
(2)ODHP法制备丙烯的反应为2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g),该反应的ΔH=-236kJ·mol-1,该法中有CO、CO2等副产物生成。在催化剂作用下C3H8的转化率和C3H6的产率随温度变化的关系如图所示:

已知:C3H6的选择性= ,则在535~575°C内C3H6的选择性___________(填字母)。
,则在535~575°C内C3H6的选择性___________(填字母)。
(3)科研人员通过电解酸化的CO2制备丙烯,装置如图所示:
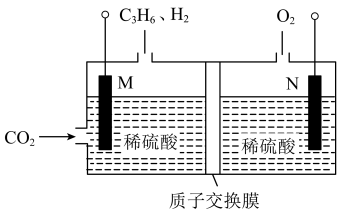
写出生成丙烯的电极反应式:_______ 。若生成丙烯的电解效率为90%,当电路中转移1mole-时,M极产生的气体在标准状况下的体积为________ L[B的电解效率= ]。
]。
(1)PDH法的反应原理为C3H8(g)⇌C3H6(g)+H2(g),该反应的ΔH=+115.4kJ·mol-1。
①已知H2(g)、C3H8(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-2219.9kJ·mol-1,则表示C3H6(g)的燃烧热的热化学方程式为
②已知PDH反应在550℃以上才能自发进行,但温度太高容易导致C-C键断裂。一定时间内(未达到平衡),下列措施一定能提高C3H6产率的是
A.选择合适的催化剂 B.升高温度 C.减小压强
③某温度下,向恒容密闭容器中充入C3H8使其仅发生PDH反应,已知起始压强为5kPa,经20min达到平衡,平衡时总压为起始时的1.8倍。若用单位时间内气体分压的变化来表示反应速率,即v=
(2)ODHP法制备丙烯的反应为2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g),该反应的ΔH=-236kJ·mol-1,该法中有CO、CO2等副产物生成。在催化剂作用下C3H8的转化率和C3H6的产率随温度变化的关系如图所示:

已知:C3H6的选择性=
| A.呈减小趋势 | B.呈增大趋势 |
| C.呈先增大后减小趋势 | D.呈先减小后增大趋势 |

写出生成丙烯的电极反应式:
2023·安徽·三模
类题推荐
丙烯是化学工业中重要的基础化学品,是制造塑料、橡胶和纤维“三大合成材料”的基本原料,若以CrOx为催化剂,会发生以下反应。
主反应:①C3H8(g) H2(g)+C3H6(g) ΔH1;
H2(g)+C3H6(g) ΔH1;
副反应:②C3H8(g) CH4(g)+C2H4(g) ΔH2;
CH4(g)+C2H4(g) ΔH2;
③C2H4(g)+H2(g) C2H6(g) ΔH3;
C2H6(g) ΔH3;
已知:
(1)则反应①的ΔH1=____ kJ·mol-1。已知该反应的ΔS=127J·mol-1·K-1,在下列哪些温度下反应能自发进行____ (填标号)
A.400℃ B.500℃ C.700℃ D.800℃
(2)以CrOx催化丙烷脱氢制备丙烯反应路程如图所示:

从物质结构角度解释第Ⅱ步活化能最大的原因____ 。
(3)工业上丙烷脱氢制备丙烯,下列说法正确的是____ 。
(4)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。某研究小组对恒温、恒压条件下由丙烷制备丙烯进行研究,向初始总压为100kPa的密闭容器中投入一定量丙烷,测得部分生成物体积分数如图。
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。某研究小组对恒温、恒压条件下由丙烷制备丙烯进行研究,向初始总压为100kPa的密闭容器中投入一定量丙烷,测得部分生成物体积分数如图。
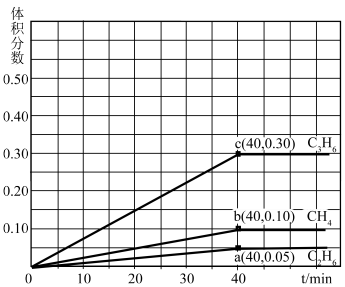
试以丙烯分压变化表示出0~40min内C3H6的平均反应速率v(C3H6)=____ kPa·min-1(已知:分压=总压×该组分物质的量分数),反应①相对压力平衡常数值为K =
=____ 。
主反应:①C3H8(g)
副反应:②C3H8(g)
③C2H4(g)+H2(g)
已知:
| 化学键 | H—H | C—H | C—C | C=C |
| 键能(kJ·mol-1) | 436 | 413 | 334 | 612 |
A.400℃ B.500℃ C.700℃ D.800℃
(2)以CrOx催化丙烷脱氢制备丙烯反应路程如图所示:

从物质结构角度解释第Ⅱ步活化能最大的原因
(3)工业上丙烷脱氢制备丙烯,下列说法正确的是
| A.增大C3H8的浓度,反应①②③的正反应速率都增加 |
| B.移除H2,反应①②③的平衡均向右移动 |
| C.在恒温恒压的密闭容器中充入适量氮气可增大丙烷的平衡转化率 |
| D.可通过选择合适催化剂提高丙烯产率 |

试以丙烯分压变化表示出0~40min内C3H6的平均反应速率v(C3H6)=
I.氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。回答下列问题:
(1)H2NCOONH4分解生成NH3与CO2气体的热化学方程式:H2NCOONH4(s) 2NH3(g)+CO2(g) ΔH=+159.5kJ/mol,恒容条件下,实验测得数据如下表所示:
2NH3(g)+CO2(g) ΔH=+159.5kJ/mol,恒容条件下,实验测得数据如下表所示:
①恒温恒容时,下列能够说明该反应已达到化学平衡状态的是___________ (填标号)。
A.容器内总压强不再改变 B.2v正(NH3)=v逆(CO2)
C.c2(NH3)∙c(CO2)的值不再改变 D.NH3的体积分数不再改变
②某温度下,该反应平衡时容器内总压强为p,写出该反应的压强平衡常数的计算式Kp=_______ (用平衡分压代替平衡浓度。分压=总压×物质的量分数)。
③随着温度升高,Kp逐渐_______ (填“增大”、“减小”或“不变”)。其主要原因是________ 。
④某温度下,达到平衡后,欲增加NH3的平衡浓度。可采取的措施有_______ (填标号)。
A.加H2NCOONH4 B.加催化剂 C.减小体积增大压强 D.移走CO2
(2)已知:RInKp= +C(C为常数)。
+C(C为常数)。
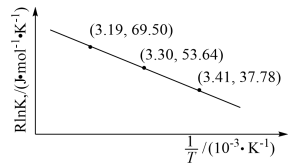
根据上表实验数据得到图象,则该反应的反应热ΔH=___________ kJ·mol-1。
II.内烯是重要的工业品。可用于制取卤代烃、内醇及塑料等。工业中以丙烷催化脱氢来制取丙烯:
主反应:C3H8(g) C3H6(g)+H2(g) ΔH1
C3H6(g)+H2(g) ΔH1
副反应:C3H8(g) CH4(g)+C2H4(g) ΔH2=+8130kJ·mol-1
CH4(g)+C2H4(g) ΔH2=+8130kJ·mol-1
已知部分化学键的键能如下表:
(3)△H1=___________ 。
(4)不同温度下,丙烷以相同的流速经过装有催化剂的管道。测得丙烷转化率。丙烯选择性和温度的关系如图1所示。下列有关丙烷催化脱氢反应说法正确的是___________。
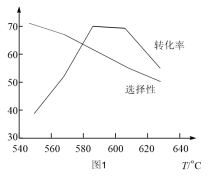
(5)某T℃时,在l0L密闭反应器中加入1mol丙烷进行催化脱氢实验,测得C3H6和C2H4的产率随时间的变化关系。如图2所示。
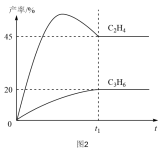
①t1前,相同时间内,C2H4的产率高于C3H6的原因是___________ 。
②T℃时,主反应的平衡常数K=___________ 。(保留2位有效数字)
(1)H2NCOONH4分解生成NH3与CO2气体的热化学方程式:H2NCOONH4(s)
| T/K | 293 | 298 | 303 | 308 | 313 |
| p/kPa | 8.60 | 11.40 | 16.24 | 20.86 | 30.66 |
①恒温恒容时,下列能够说明该反应已达到化学平衡状态的是
A.容器内总压强不再改变 B.2v正(NH3)=v逆(CO2)
C.c2(NH3)∙c(CO2)的值不再改变 D.NH3的体积分数不再改变
②某温度下,该反应平衡时容器内总压强为p,写出该反应的压强平衡常数的计算式Kp=
③随着温度升高,Kp逐渐
④某温度下,达到平衡后,欲增加NH3的平衡浓度。可采取的措施有
A.加H2NCOONH4 B.加催化剂 C.减小体积增大压强 D.移走CO2
(2)已知:RInKp=

根据上表实验数据得到图象,则该反应的反应热ΔH=
II.内烯是重要的工业品。可用于制取卤代烃、内醇及塑料等。工业中以丙烷催化脱氢来制取丙烯:
主反应:C3H8(g)
副反应:C3H8(g)
已知部分化学键的键能如下表:
| 共价键 | C-C | C=C | C-H | H-H |
| 键能(kJ·mol-1) | 348 | 615 | 413 | 436 |
(4)不同温度下,丙烷以相同的流速经过装有催化剂的管道。测得丙烷转化率。丙烯选择性和温度的关系如图1所示。下列有关丙烷催化脱氢反应说法正确的是___________。

| A.主、副反应的ΔS相等 |
| B.温度升高,丙烯的产率增大 |
| C.单位时间内生成1molH-H键,同时消耗lmolC=C键,反应未达到平衡 |
| D.高于600°C,温度升高,主、副反应平衡逆移,导致丙烷转化率下降 |

①t1前,相同时间内,C2H4的产率高于C3H6的原因是
②T℃时,主反应的平衡常数K=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网