解答题-工业流程题 较难0.4 引用2 组卷334
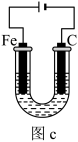
工业上以铬铁矿(FeCr2O4质量分数为a%,含Al2O3、SiO2等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程图如图,回答下列问题:
(1)焙烧的目的是将FeCr2O4转化为Na2CrO4,写出转化过程中生成可溶性含铝组分的化学方程式:______ 。
(2)下列有关说法不正确 的是______ 。
(3)蒸发结晶,盛放样品的容器名称是_______ 。
(4)酸化的目的是(结合离子方程式说明)______ 。
(5)利用氧化还原滴定法测定Na2Cr2O7•2H2O产品的纯度,从下列选项中选择合适的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器,“(_______)”内填写一种操作 ,均用字母表示]。用______ (称量产品2.50g)→在烧杯中__________ →用容量瓶__________ →用移液管(取25.00mL所配溶液于锥形瓶中)→加入足量碘化钠溶液→加入3滴淀粉指示剂→用______ (用0.1200mol•L-1Na2S2O3标准溶液滴定)→_________ 并且 内不恢复原来的颜色,消耗标准溶液40.00mL
内不恢复原来的颜色,消耗标准溶液40.00mL
仪器:a.碱式滴定管;b.酸式滴定管;c.电子天平;d.托盘天平;
操作:e.加硫酸溶解;f.加盐酸溶解;g.配制250mL溶液;h.观察到溶液蓝色褪去:i.观察到溶液变成蓝色
(6)若以铬铁矿为原料制备mkg硼化铬(CrB),在工艺流程中Cr损失b%,则至少需要铬铁矿的质量为______ kg(用含字母的计算式表示)。

(1)焙烧的目的是将FeCr2O4转化为Na2CrO4,写出转化过程中生成可溶性含铝组分的化学方程式:
(2)下列有关说法
| A.蒸发结晶时如果长时间蒸发,有利于提高Na2Cr2O7•2H2O的产率 |
| B.除了Na2Cr2O7外,在上述工艺流程中可循环利用的物质还有H2SO4 |
| C.含铁元素的化合物可在中和过程中被除去 |
| D.焙烧时气流与矿料逆流而行,其目的是增大反应物接触面积,提高反应速率 |
(4)酸化的目的是(结合离子方程式说明)
(5)利用氧化还原滴定法测定Na2Cr2O7•2H2O产品的纯度,从下列选项中选择合适的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器,“(_______)”内填写
仪器:a.碱式滴定管;b.酸式滴定管;c.电子天平;d.托盘天平;
操作:e.加硫酸溶解;f.加盐酸溶解;g.配制250mL溶液;h.观察到溶液蓝色褪去:i.观察到溶液变成蓝色
(6)若以铬铁矿为原料制备mkg硼化铬(CrB),在工艺流程中Cr损失b%,则至少需要铬铁矿的质量为
2023·浙江·模拟预测
类题推荐
用硫铁矿(主要成分是FeS2, 含少量Al2O3、 SiO2和Fe3O4)为原料, 制备磷酸亚铁锂(LiFePO4),流程如下图所示:

已知几种金属离子沉淀的pH如下表所示:
回答下列问题:
(1)焙烧的目的是___________ 。
(2)流程中从“焙烧”到“氧化”要经过一系列步骤,从下列步骤中选择正确的步骤并合理排序___________→___________→___________→___________。_________

(3)“试剂R”最好选择___________ 。
(4)流程中“高温煅烧”时,反应的化学方程式为___________ 。
(5)检验产品中是否混有Fe(OH)3或FePO4杂质的实验操作是___________ 。
(6)用0.100 mol·L-1酸性K2Cr2O7标准溶液滴定Fe2+,测定产品LiFePO4的纯度。
①从下列选项中选择合理的仪器和操作,补全如下步骤[“___________”上填写一件最关键的仪器,“___________ )”内填写一种操作,均用字母表示]。__________
用___________(称量LiFePO4样品8.000 g)→用烧杯(___________ ) →用___________(___________ )→用___________(量取25.00 mL Fe2+溶液)→滴加2~3滴二苯胺磺酸钠作指示剂→用滴定管(盛装K2Cr2O7标准溶液,滴定至溶液由浅绿色变为蓝紫色)→(重复滴定3次,平均消耗K2Cr2O7溶液20.00 mL)。
仪器: a.量筒; b.托盘天平; c. 100 mL容量瓶; d.分析天平; e.试剂瓶; f.移液管。
操作: g.配制一定体积的 Fe2+溶液; h.加稀硫酸溶解样品; i.装瓶贴标签。
②产品的纯度为___________ 。

已知几种金属离子沉淀的pH如下表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
(1)焙烧的目的是
(2)流程中从“焙烧”到“氧化”要经过一系列步骤,从下列步骤中选择正确的步骤并合理排序___________→___________→___________→___________。

(3)“试剂R”最好选择
(4)流程中“高温煅烧”时,反应的化学方程式为
(5)检验产品中是否混有Fe(OH)3或FePO4杂质的实验操作是
(6)用0.100 mol·L-1酸性K2Cr2O7标准溶液滴定Fe2+,测定产品LiFePO4的纯度。
①从下列选项中选择合理的仪器和操作,补全如下步骤[“___________”上填写一件最关键的仪器,“___________ )”内填写一种操作,均用字母表示]。
用___________(称量LiFePO4样品8.000 g)→用烧杯(___________ ) →用___________(___________ )→用___________(量取25.00 mL Fe2+溶液)→滴加2~3滴二苯胺磺酸钠作指示剂→用滴定管(盛装K2Cr2O7标准溶液,滴定至溶液由浅绿色变为蓝紫色)→(重复滴定3次,平均消耗K2Cr2O7溶液20.00 mL)。
仪器: a.量筒; b.托盘天平; c. 100 mL容量瓶; d.分析天平; e.试剂瓶; f.移液管。
操作: g.配制一定体积的 Fe2+溶液; h.加稀硫酸溶解样品; i.装瓶贴标签。
②产品的纯度为
某研究小组制备 ,再利用高温合成法制备无水
,再利用高温合成法制备无水 ,流程如下:
,流程如下:
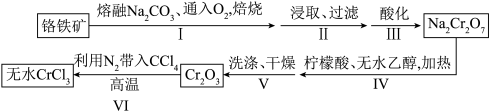
已知:(1)铬铁矿的主要成分为 。
。
(2) 高温条件下能被氧化。
高温条件下能被氧化。
请回答:
(1)下列有关说法不正确 的是_______。
(2)已知 的沸点为
的沸点为 ,为保证稳定的气流,适宜的加热方式为
,为保证稳定的气流,适宜的加热方式为_______ 。
(3)制备无水 时,在
时,在 的条件下进行的目的是
的条件下进行的目的是_______ 。
(4)为测定无水 中铬元素含量,可用已知浓度的硫酸亚铁铵标准溶液滴定
中铬元素含量,可用已知浓度的硫酸亚铁铵标准溶液滴定 。从下列选项中选择合理的仪器和操作,补全如下步骤[“_______”上填写
。从下列选项中选择合理的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器 ,“”内填写一种操作 ,均用字母表示]。_______(精确称取无水 样品
样品 )→放入锥形瓶中(_______)→往锥形瓶中(_______)(_______)→用_______(盛装硫酸亚铁铵标准溶液,滴定
)→放入锥形瓶中(_______)→往锥形瓶中(_______)(_______)→用_______(盛装硫酸亚铁铵标准溶液,滴定 )→滴定至中)
)→滴定至中) _______ 。
【仪器】a.托盘天平;b.酸式滴定管;c.分析天平;d.碱式滴定管;e.锥形瓶
【操作】f.加2滴 -苯代邻氨基苯甲酸溶液;g.加
-苯代邻氨基苯甲酸溶液;g.加 后加热至样品溶解; h.加入过硫酸铵溶液,加热使
后加热至样品溶解; h.加入过硫酸铵溶液,加热使 氧化成
氧化成 ,冷却; i.溶液颜色由櫻桃红色变为亮绿色至滴定终点
,冷却; i.溶液颜色由櫻桃红色变为亮绿色至滴定终点
(5)如果固态 中有痕量的
中有痕量的 存在,则与水迅速反应生成
存在,则与水迅速反应生成 的水合物,将其溶液蒸发可析暗绿色的
的水合物,将其溶液蒸发可析暗绿色的 晶体,若将暗绿色溶液冷却到
晶体,若将暗绿色溶液冷却到 以下,并通入
以下,并通入 气体,则可析出紫色晶体。用乙醚处理紫色溶液并通入
气体,则可析出紫色晶体。用乙醚处理紫色溶液并通入 气体后,就析出了另一种淡绿色晶体,则上述紫色晶体和淡绿色晶体的化学式分别为
气体后,就析出了另一种淡绿色晶体,则上述紫色晶体和淡绿色晶体的化学式分别为_______ 、_______ 。(已知等量的暗绿色晶体、紫色晶体、淡绿色晶体消耗的硝酸银的物质的量之比为 )
)

已知:(1)铬铁矿的主要成分为
(2)
请回答:
(1)下列有关说法
| A.步骤Ⅰ,将铬铁矿置于熔盐形成的液体中可增大接触面积,加快反应速率 |
| B.步骤Ⅱ,浸取过滤后所得滤渣为 |
| C.步骤Ⅴ,用蒸馏水反复洗涤样品至滴下液体为无色时,可视为洗涤完成 |
| D.步骤Ⅵ,不断增大 |
(3)制备无水
(4)为测定无水
【仪器】a.托盘天平;b.酸式滴定管;c.分析天平;d.碱式滴定管;e.锥形瓶
【操作】f.加2滴
(5)如果固态
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网