解答题-工业流程题 困难0.15 引用1 组卷734
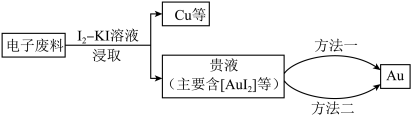
研究从电子废料(含金属铜和金)中回收金,主要过程如下。
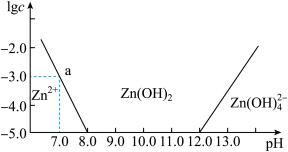
已知: ;相同条件下,
;相同条件下, 与
与 的氧化性相近。
的氧化性相近。
(1)浸出 的离子方程式是
的离子方程式是___________ 。
(2)饱和碘水不能单独浸出 ,但是
,但是 溶液可以浸出
溶液可以浸出 ,原因有:
,原因有:
ⅰ. 在
在 溶液中的溶解度大,体系的氧化性强;
溶液中的溶解度大,体系的氧化性强;
ii.___________ 。
(3)浸取一定时间后,应及时过滤,否则会降低金的浸出率,原因是___________ 。
(4)方法一:用 还原。写出析出
还原。写出析出 的离子方程式:
的离子方程式:___________ 。
(5)方法二:用惰性电极电解,装置示意图如下。
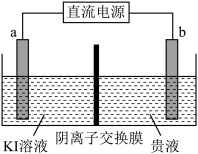
①___________ (填“a”或“b”)接电源的负极。
②直接电解贵液,不用阴离子交换膜,金的沉积率会降低,原因是___________ 。
(6)与方法一对比:
①方法二的优点是___________ ;
②方法二的缺点是金的纯度较低,可用___________ (填试剂)进一步纯化。

已知:
(1)浸出
(2)饱和碘水不能单独浸出
ⅰ.
ii.
(3)浸取一定时间后,应及时过滤,否则会降低金的浸出率,原因是
(4)方法一:用
(5)方法二:用惰性电极电解,装置示意图如下。

①
②直接电解贵液,不用阴离子交换膜,金的沉积率会降低,原因是
(6)与方法一对比:
①方法二的优点是
②方法二的缺点是金的纯度较低,可用
2023·北京东城·二模
类题推荐
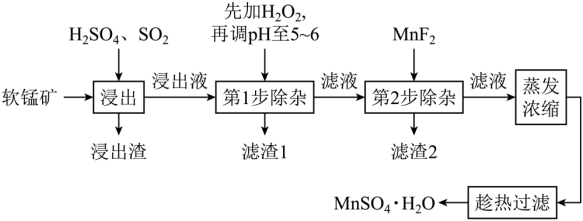
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为___________ 。
(2)第1步除杂中加入H2O2的目的是___________ 。
(3)第1步除杂中形成滤渣1的主要成分为___________ (填化学式),调pH至5~6所加的试剂,可选择___________ (填以下试剂的序号字母)。
a.CaO b.MnCO3 c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式:___________ 。(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11)
(5)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是___________ (用离子方程式表示)。
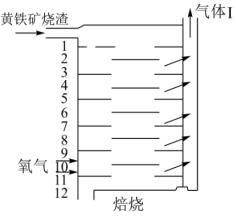
(6)工艺流程中矿渣的预处理通常有酸浸、碱浸、焙烧等方式。黄铁矿渣焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是___________ (任答两点)。

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(2)第1步除杂中加入H2O2的目的是
(3)第1步除杂中形成滤渣1的主要成分为
a.CaO b.MnCO3 c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式:
(5)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是
(6)工艺流程中矿渣的预处理通常有酸浸、碱浸、焙烧等方式。黄铁矿渣焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网