解答题-工业流程题 适中0.65 引用2 组卷301
从铜电解液(主要含Cu2+、Ni2+、Fe2+、Fe3+、Ca2+、Zn2+等)中提纯可得到粗硫酸镍晶体,某课题小组为了进一步精制纯化并回收胆矾晶体,设计了如图流程:
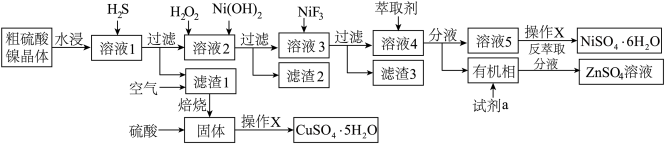
已知:相关离子浓度为0.1 mol· L-1时,形成氢氧化物沉淀的pH范围如下:
(1)为加快“水浸”时的浸出率,可采取的措施有 _______ ,“滤渣1”的主要成份是_______ 。
(2)为了使“溶液1”中的反应充分进行,需要通入稍过量的H2S,写出Fe3+与H2S发生反应的离子方程式______ 。
(3)解释向“溶液2”中加入Ni(OH)2的原因_______ 。
(4)“操作X”为在_______ (填仪器名称)中加热至_______ 冷却结晶过滤、洗涤、干燥后得到结晶水合物晶体。
(5)若“溶液3”中Ca2+的浓度为0.001 mol·L-1,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5 mol· L-1,则所加NiF2溶液的浓度至少为_______ mol · L-1。[已知室温下Ksp(CaF2)=4×10-11]
(6)室温下选择萃取剂P204(二乙基已基磷酸,用HR表示),其萃取原理为nHR +Mn+ MRn +nH+,试剂a为
MRn +nH+,试剂a为_____ (填化学式)。溶液pH对几种离子的萃取率的影响如图,则萃取锌时,应控制pH的范围为3~4,请解释原因_______ 。

已知:相关离子浓度为0.1 mol· L-1时,形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Ca2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 4.2 | 6.3 | 1.5 | 11.8 | 6.2 | 6.9 |
| 沉淀完全的pH | 6.7 | 8.3 | 2.8 | 13.8 | 8.2 | 8.9 |
(2)为了使“溶液1”中的反应充分进行,需要通入稍过量的H2S,写出Fe3+与H2S发生反应的离子方程式
(3)解释向“溶液2”中加入Ni(OH)2的原因
(4)“操作X”为在
(5)若“溶液3”中Ca2+的浓度为0.001 mol·L-1,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5 mol· L-1,则所加NiF2溶液的浓度至少为
(6)室温下选择萃取剂P204(二乙基已基磷酸,用HR表示),其萃取原理为nHR +Mn+

2023·内蒙古乌兰察布·二模
类题推荐
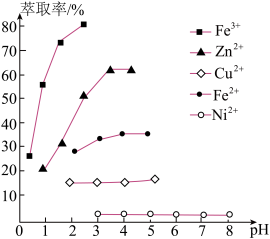
从工业含镍的废液(主要含Ni2+,Cu2+,Fe2+,Ca2+,Zn2+等)中提纯得到硫酸镍晶体并回收胆矾晶体,某课题小组设计了图流程:
(1)基态Ni2+的价层电子排布式为_______ 。
(2)“滤渣”在空气中焙烧产生一种气体,其化学式为_______ 。
(3)请写出向“溶液1”中依次加入 、
、 的离子方程式
的离子方程式_______ 。
(4)若“溶液2”中 的浓度为0.01mol/L,取等体积的
的浓度为0.01mol/L,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时 ,则所加
,则所加 溶液的浓度至少为
溶液的浓度至少为_______  。[已知室温下
。[已知室温下 ]
]
(5)室温下选择萃取剂 (二乙基已基磷酸,用HR表示),其萃取原理为(
(二乙基已基磷酸,用HR表示),其萃取原理为( ,试剂a为
,试剂a为_______ (填化学式);若溶液3加萃取剂前pH=3,c(Zn2+)=0.011mol/L,多次萃取后水相中c(H+)为1.3×10-2mol/L,则锌的萃取率为_______ %(结果保留一位小数,溶液体积变化忽略不计)。溶液pH对几种离子的萃取率的影响如图,萃取锌时,控制pH的范围为3~4原因是_______ 。
| 金属离子 | ||||||
| 开始沉淀的pH | 4.2 | 6.3 | 1.5 | 11.8 | 6.2 | 6.9 |
| 沉淀完全的pH | 6.7 | 8.3 | 2.8 | 13.8 | 8.2 | 8.9 |
(1)基态Ni2+的价层电子排布式为
(2)“滤渣”在空气中焙烧产生一种气体,其化学式为
(3)请写出向“溶液1”中依次加入
(4)若“溶液2”中
(5)室温下选择萃取剂
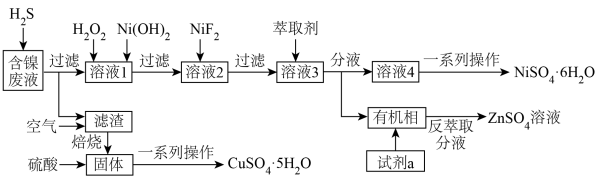
铜电解液中主要含 Cu2+、Ni2+、Fe2+、Fe3+、Ca2+、Zn2+等,为提纯得到粗硫酸镍晶体和胆矾晶体, 某兴趣小组设计了如图流程:
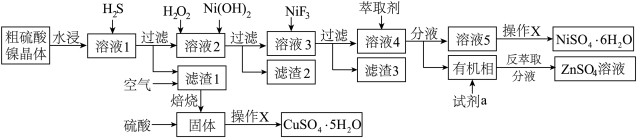
已知:相关离子浓度为0.1mol/L时形成氢氧化物沉淀的pH范围如下:
(1)基态Cu原子的价电子排布式为___________ ,H2O2是___________ (填“极性”或“非极性”)分子。
(2)向“溶液1”中通入稍过量的H2S,写出主要反应的离子方程式:________ 、________ 。
(3)请结合离子方程式解释向“溶液2”中加入Ni(OH)2的原因___________ 。
(4)若“溶液3”中Ca2+的浓度为0.002mol/L,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5mol/L,则所加NiF2溶液的浓度至少为___________ mol/L。【已知室温下Ksp (CaF2)=4×10-11】
(5)室温下选择萃取剂HR,其萃取原理为:nHR+Mn+ MRn+nH+,溶液 pH 对几种离子的萃取率的 影响如图,则萃取锌时,应控制pH的范围为 3~4,请解释原因:
MRn+nH+,溶液 pH 对几种离子的萃取率的 影响如图,则萃取锌时,应控制pH的范围为 3~4,请解释原因:___________ 。试剂a为___________ (填化学式)。

(6)铅和银均为用途广泛的重金属,其中银的一种化合物五唑银(AgN5 )作为新型高能含能材料,在炸药、推进剂等领域具有较高的应用价值。AgN5的立方晶胞结构如图所示,晶胞参数为apm。图中,粒子1的原子分数坐标为( ,
, ,0),则粒子2的原子分数坐标为
,0),则粒子2的原子分数坐标为___________ 。设阿伏加德罗常数的值为NA,则AgN5晶体的密度为___________ g/cm3 (列出计算表达式)。


已知:相关离子浓度为0.1mol/L时形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Ca2+ | Zn2+ | Ni2+ |
| 开始沉淀的 pH | 4.2 | 6.3 | 1.5 | 11.8 | 6.2 | 6.9 |
| 沉淀完全的 pH | 6.7 | 8.3 | 2.8 | 13.8 | 8.2 | 8.9 |
(2)向“溶液1”中通入稍过量的H2S,写出主要反应的离子方程式:
(3)请结合离子方程式解释向“溶液2”中加入Ni(OH)2的原因
(4)若“溶液3”中Ca2+的浓度为0.002mol/L,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5mol/L,则所加NiF2溶液的浓度至少为
(5)室温下选择萃取剂HR,其萃取原理为:nHR+Mn+

(6)铅和银均为用途广泛的重金属,其中银的一种化合物五唑银(AgN5 )作为新型高能含能材料,在炸药、推进剂等领域具有较高的应用价值。AgN5的立方晶胞结构如图所示,晶胞参数为apm。图中,粒子1的原子分数坐标为(

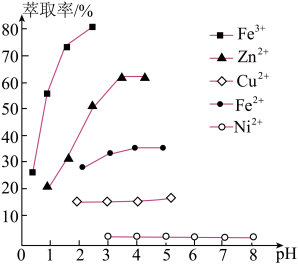
工业上利用废镍催化剂(主要成分为NiO,还含有一定量的ZnO、Fe2O3、SiO2、CaO等)制备一水合氢氧化氧镍(2NiOOH·H2O)的工艺流程如图:
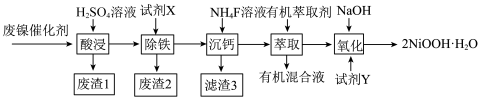
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)写出一种能提高“酸浸”速率的措施:___ ;滤渣1的成分是___ (填化学式)。
(2)试剂X用于调节溶液的pH,则调控pH的范围是___ 。
(3)已知“除铁”后所得100mL溶液中c(Ca2+)=0.01mol·L-1,加入100mLNH4F溶液(忽略混合后溶液体积的变化),使Ca2+恰好沉淀完全[此时c(Ca2+)=1×10-5mol·L-1],则所加溶液c(NH4F)=___ mol·L-1[已知实验条件下,Ksp(CaF2)=4×10-9,不考虑F-的水解]。
(4)“氧化”过程中加入的试剂Y可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成一水合氢氧化氧镍(2NiOOH·H2O)的离子方程式:___ 。
(5)加入有机萃取剂的作用是___ 。
(6)已知工业上也可以用Ni(OH)2作为阳极、NaOH溶液为电解质溶液,通过电解氧化法制备NiOOH,其阳极的电极反应式为___ 。

相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Ca2+ | Zn2+ | Ni2+ | Fe3+ |
| 开始沉淀时的pH | 10.6 | 7.6 | 7.1 | 1.5 |
| 完全沉淀时的pH | 13.1 | 8.3 | 9.2 | 2.8 |
(1)写出一种能提高“酸浸”速率的措施:
(2)试剂X用于调节溶液的pH,则调控pH的范围是
(3)已知“除铁”后所得100mL溶液中c(Ca2+)=0.01mol·L-1,加入100mLNH4F溶液(忽略混合后溶液体积的变化),使Ca2+恰好沉淀完全[此时c(Ca2+)=1×10-5mol·L-1],则所加溶液c(NH4F)=
(4)“氧化”过程中加入的试剂Y可以是NaClO、K2S2O8、KMnO4等,写出加入K2S2O8反应生成一水合氢氧化氧镍(2NiOOH·H2O)的离子方程式:
(5)加入有机萃取剂的作用是
(6)已知工业上也可以用Ni(OH)2作为阳极、NaOH溶液为电解质溶液,通过电解氧化法制备NiOOH,其阳极的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


