解答题-原理综合题 较难0.4 引用1 组卷149
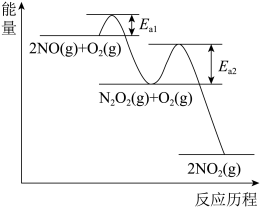
工业上常用 和
和 合成尿素
合成尿素 ,反应可分两步进行:
,反应可分两步进行:
①
 kJ⋅mol
kJ⋅mol
②
 kJ⋅mol
kJ⋅mol
(1)以 、
、 为原料生产尿素
为原料生产尿素 的总反应热化学方程式为
的总反应热化学方程式为_______ 。
(2)反应①为快反应,需在高压冷凝器中进行,采用高压冷凝的原因为_______ 。
(3)一定温度下,将 和
和 按2∶1的物质的量之比充入一容积恒为10 L的密闭容器中发生总反应。20 min时达到平衡,各物质的浓度变化曲线如图所示。
按2∶1的物质的量之比充入一容积恒为10 L的密闭容器中发生总反应。20 min时达到平衡,各物质的浓度变化曲线如图所示。
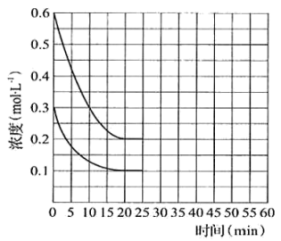
①能说明体系达到平衡状态的是_______ (填字母)。
A.混合气体的平均相对分子质量不再变化 B.容器内固体质量不再变化
C. 和
和 的转化率相等 D.水蒸气的浓度不再变化
的转化率相等 D.水蒸气的浓度不再变化
②25 min时再向容器中充入2 mol的 和1.5 mol
和1.5 mol  ,在45 min时重新达到平衡。45 min时
,在45 min时重新达到平衡。45 min时 的总转化率为
的总转化率为_______ (精确至0.1%);再次平衡时总反应的平衡常数为_______ 。
③请在图中画出25~50 min内 的浓度变化曲线
的浓度变化曲线_______ 。
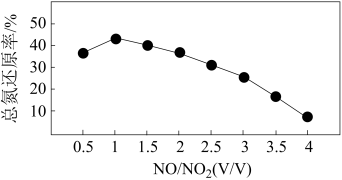
(4)用尿素溶液吸收氮氧化物,可用于处理汽车尾气。NO和 不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。
不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。
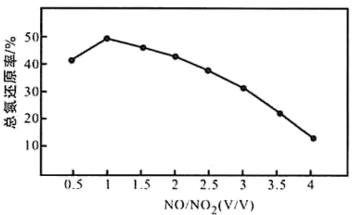
①用尿素水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式_______ 。
②随着NO和 配比的提高,总氮还原率降低的主要原因是
配比的提高,总氮还原率降低的主要原因是_______ 。
①
②
(1)以
(2)反应①为快反应,需在高压冷凝器中进行,采用高压冷凝的原因为
(3)一定温度下,将

①能说明体系达到平衡状态的是
A.混合气体的平均相对分子质量不再变化 B.容器内固体质量不再变化
C.
②25 min时再向容器中充入2 mol的
③请在图中画出25~50 min内
(4)用尿素溶液吸收氮氧化物,可用于处理汽车尾气。NO和

①用尿素水溶液吸收体积比为1∶1的NO和
②随着NO和
22-23高三上·福建龙岩·期末
类题推荐
工业上常利用CO2为初始反应物,合成一系列重要的化工原料。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)=NH2COONH4(s)ΔH1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
请回答下列问题:
①反应Ⅰ的ΔH1=______________ 。
②在________ (填“高温”或“低温”)情况下有利于反应Ⅱ的自发进行。
③一定温度下,在体积固定的密闭容器中按n(NH3)∶n(CO2)=2∶1 进行反应Ⅰ。下列能说明反应Ⅰ达到了平衡状态的是____________ (填字母代号)。
A 混合气体的平均相对分子质量不再变化
B 容器内气体总压强不再变化
C NH3与CO2的转化率相等
D 容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25∶3充入一定体积的密闭容器中,在不同温度下发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CH3OH(g)的物质的量随时间的变化如下图所示。
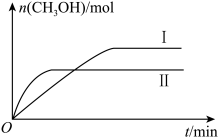
①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)______ (填“>”“<”或“=”)K(Ⅱ)。
②欲提高CH3OH(g)的平衡产率,可采取的措施除改变温度外,还有__________ (任写两种)。
③一定温度下,在容积均为2 L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
若甲容器中反应达平衡后气体的压强为开始时的 ,则该温度下,反应的平衡常数为
,则该温度下,反应的平衡常数为______ ;要使反应达平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_______________ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)=NH2COONH4(s)ΔH1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
请回答下列问题:
①反应Ⅰ的ΔH1=
②在
③一定温度下,在体积固定的密闭容器中按n(NH3)∶n(CO2)=2∶1 进行反应Ⅰ。下列能说明反应Ⅰ达到了平衡状态的是
A 混合气体的平均相对分子质量不再变化
B 容器内气体总压强不再变化
C NH3与CO2的转化率相等
D 容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25∶3充入一定体积的密闭容器中,在不同温度下发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CH3OH(g)的物质的量随时间的变化如下图所示。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)
②欲提高CH3OH(g)的平衡产率,可采取的措施除改变温度外,还有
③一定温度下,在容积均为2 L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
| 容器 | 甲 | 乙 |
| 反应物起 始投入量 | 1 mol CO2、 3 mol H2 | a mol CO2 b mol H2 c mol CH3OH(g) c mol H2O(g) (a,b,c均不为0) |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1


