解答题-实验探究题 适中0.65 引用1 组卷209
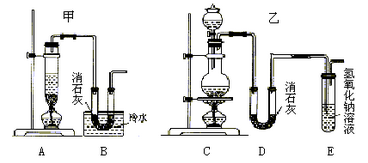
实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有两个同学分别设计的两套实验装置如图:
(1)写出氯气和氢氧化钠溶液反应的的离子方程式___________ 。
(2)请从以下几个方面对甲乙两套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表格中。
a.不容易控制反应速率; b.容易控制反应速率; c.有副反应发生;
d.可防止副反应发生; e.污染环境; f.可防止污染环境。
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是(按气流流动的方向)___________ ,该组合中还缺少的装置是___________ 。
(4)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2的方法有多种,其中一种方法的化学方程式如下:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①该反应的还原剂是___________ 。若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为___________ L。
②某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与 的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为___________ 。

(1)写出氯气和氢氧化钠溶液反应的的离子方程式
(2)请从以下几个方面对甲乙两套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表格中。
a.不容易控制反应速率; b.容易控制反应速率; c.有副反应发生;
d.可防止副反应发生; e.污染环境; f.可防止污染环境。
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 |
(4)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2的方法有多种,其中一种方法的化学方程式如下:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①该反应的还原剂是
②某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与
18-19高一上·北京海淀·期末
类题推荐
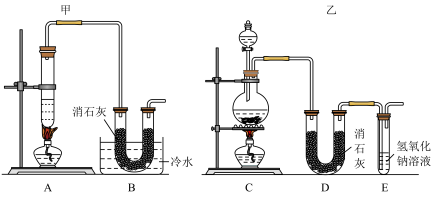
实验室用浓盐酸、二氧化锰共热制氯气,并用制得的氯气和氢氧化钙制取少量漂粉精。现已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O是放热反应。温度稍高会发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
现有3个同学分别设计的3套实验装置如图:
(1)C装置中发生反应的化学方程式为:___ ,E装置中发生反应的化学方程式为:___ 。
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。___
a.不容易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.污染环境 f.可防止污染环境
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分的连接顺序是___ (按气流流动的方向)。该组合中还缺少的装置是___ (用文字说明),需要该装置的原因是___ 。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过___ mol。
现有3个同学分别设计的3套实验装置如图:

(1)C装置中发生反应的化学方程式为:
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。
a.不容易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.污染环境 f.可防止污染环境
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分的连接顺序是
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过
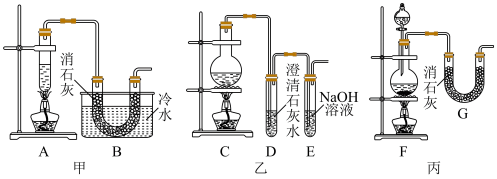
实验室为了制得少量漂白粉,常用浓盐酸与二氧化锰先制取氯气,再用氯气与消石灰反应。已知氯气与氢氧化钙制漂白粉是放热反应[2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2
Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。
Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。

(1)请对三套装置的优缺点进行评价,并将选项序号填于下表内。
a.不容易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.污染环境 f.可防止污染环境
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G)组装一套你认为更完整的实验装置,则连接顺序为(按气流从左到右方向)____________ 。
(3)在你所设计的装置及以上甲、乙、丙装置中,是否还缺少其他必要的装置,说明原因:_________ 。
 Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2
Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。
Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。
(1)请对三套装置的优缺点进行评价,并将选项序号填于下表内。
a.不容易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.污染环境 f.可防止污染环境
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G)组装一套你认为更完整的实验装置,则连接顺序为(按气流从左到右方向)
(3)在你所设计的装置及以上甲、乙、丙装置中,是否还缺少其他必要的装置,说明原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网