解答题-原理综合题 适中0.65 引用1 组卷148
随着农业发展和军工生产的需要,科学家们先后研究并实现了氨的工业生产,今日粮食的产量之高也离不开合成氨工业的发展。除了氨气外,含氮物质在生活中也随处可见。
(1)下列关于NH3性质的解释合理的是______ (单选)。
(2)合成氨工业先驱哈伯(P•Haber)利用N2和H2在Fe催化作用下最早人工合成氨气,请根据表中键能的相关数据,计算合成氨反应的热效应:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=______ kJ•mol-1。
(3)下列关于合成氨工艺的下列理解,正确的是______ (单选)。
(4)尿素(NH2CONH2)又称碳酰胺,是含氮量最高的氮肥,同时也是一种重要的化工产品,有很多用途。工业上利用二氧化碳和氨气在一定条件下合成尿素,涉及的反应如下:
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式______ 。
(5)上述反应自发进行的条件是______ (填“低温”、“高温”或“任意条件”)。
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式______ 。
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
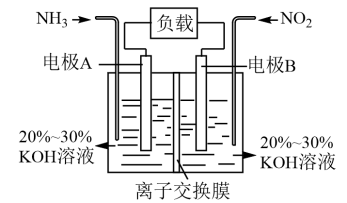
其中A电极的电极反应式为______ 。
(8)下列关于该电池的说法正确的是______ (不定项)。
(1)下列关于NH3性质的解释合理的是
| A.NH3分子中氮原子的杂化方式是sp2,空间构型是平面三角形 |
| B.NH3分子中氮原子的价层电子对数为3 |
| C.8NH3+3Cl2=N2+6NH4Cl中氧化剂与还原剂的物质的量之比为3:2 |
| D.氨水中存在NH |
| 化学键 | HH | NH | N≡N |
| 键能/( kJ•mol-1) | 436 | 391 | 945 |
| A.当温度、压强一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率 |
| B.增大体系的压强能增大活化分子的百分数,从而加快反应速率 |
| C.合成氨反应选择在高温条件下进行时为了使平衡向正反应方向 |
| D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生 |
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式
(5)上述反应自发进行的条件是
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。

其中A电极的电极反应式为
(8)下列关于该电池的说法正确的是
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阳离子交换膜 |
| C.反应的总方程是6NO2+8NH3=7N2+12H2O |
| D.当有4.48LNO2(标准状况下)被处理时,转移电子物质的量为0.8mol |
22-23高二下·上海宝山·期中
类题推荐
合成氨工艺是人工固氮的重要途径。
I.N2和H2生成NH3反应的反应热(ΔH)、活化能(Ea)为:0.5N2(g)+1.5H2(g) NH3(g) ΔH (298K)= -46.2kJ ·mol-1 Ea= 253.8kJ·mol-l
NH3(g) ΔH (298K)= -46.2kJ ·mol-1 Ea= 253.8kJ·mol-l
(1)氨的分解反应2NH3(g) N2(g)+3H2(g)的活化能 Ea=
N2(g)+3H2(g)的活化能 Ea=___________ 。
(2)下列关于该合成氨工艺的理解正确的是___________ 。
A.合成氨实际工业生产条件是高温、高压、合适的催化剂
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,不会改变平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,有利于提高正反应速率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
II.一些学者对甲烷-氮气直接合成氨进行了研究。
(3)不同温度条件对反应的影响
常压时在某催化剂作用下,将75%CH4—25%N2 (体积分数)混合原料气通入反应器,流速恒为60mL ·min-1.催化剂的活性以速率v (mol·g-1·s-1 )表示,计算公式:v=n/mt (式中,n为物。质的量/mol, m为催化剂质量/g,t 为吸收时间/s)。得下表数据:
①分析表中数据可知,甲烷的转化速率随温度的升高而___________ ( 填“增大“减小”或“不变”),用碰撞理论解释原因:___________ 。
②研究表明,提高温度有利于提高反应速率,也会生成石墨碳造成催化剂表面积炭,故700℃ 为该反应的理想温度。根据上表数据,计算700°C时甲烷的转化率___________ (用含Vm的算式表示,该反应条件下气体摩尔体积为Vm L·mol-1)。
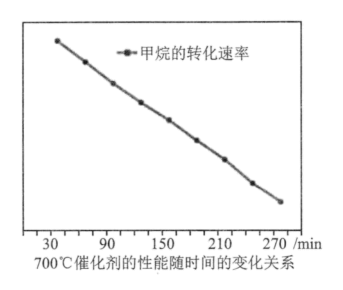
③700℃ 时,某催化剂对甲烷氮气合成氨的反应,甲烷转化速率随反应时间变化的关系如图所示。请在此图上画出氨的生成速率随反应时间变化的关系图___________ 。
(4)另有学者研究甲烷-氮气在质子交换膜作用下低温常压电化学合成氨,同时获得副产品乙烯。写出该过程的阳极电极反应式:___________ 。
I.N2和H2生成NH3反应的反应热(ΔH)、活化能(Ea)为:0.5N2(g)+1.5H2(g)
(1)氨的分解反应2NH3(g)
(2)下列关于该合成氨工艺的理解正确的是
A.合成氨实际工业生产条件是高温、高压、合适的催化剂
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,不会改变平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,有利于提高正反应速率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
II.一些学者对甲烷-氮气直接合成氨进行了研究。
(3)不同温度条件对反应的影响
常压时在某催化剂作用下,将75%CH4—25%N2 (体积分数)混合原料气通入反应器,流速恒为60mL ·min-1.催化剂的活性以速率v (mol·g-1·s-1 )表示,计算公式:v=n/mt (式中,n为物。质的量/mol, m为催化剂质量/g,t 为吸收时间/s)。得下表数据:
| 催化剂 | 温度 | 甲烷转化速率 / mol·g-1·s-1 | 选择性/% | 氨生成速率。 / mol·g-1·s-1 | ||
| 乙烯 | 乙烷 | 其它 | ||||
| 15g | ≤500℃ | / | / | / | / | / |
| 15g | 600°C | 7.0×10-8 | 0.25 | 0.44 | 99.31 | 3.167×10-9 |
| 15g | 700°C | 6.0× 10-7 | 0.054 | 0.056 | 99.89 | 1.264 ×10-8 |
| 15g | 800°C | 2.0 ×10-6 | 0.0146 | 0.006 | 99.98 | 1.645 ×10-8 |
②研究表明,提高温度有利于提高反应速率,也会生成石墨碳造成催化剂表面积炭,故700℃ 为该反应的理想温度。根据上表数据,计算700°C时甲烷的转化率
③700℃ 时,某催化剂对甲烷氮气合成氨的反应,甲烷转化速率随反应时间变化的关系如图所示。请在此图上画出氨的生成速率随反应时间变化的关系图

(4)另有学者研究甲烷-氮气在质子交换膜作用下低温常压电化学合成氨,同时获得副产品乙烯。写出该过程的阳极电极反应式:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网