解答题-实验探究题 适中0.65 引用3 组卷347
氰化钠 是一种重要的基本化工原料,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用双氧水或硫代硫酸钠(
是一种重要的基本化工原料,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用双氧水或硫代硫酸钠( )溶液来处理,以减轻环境污染。
)溶液来处理,以减轻环境污染。
(1) 易水解生成氰化氢(有剧毒,易在空气中均匀弥散)。
易水解生成氰化氢(有剧毒,易在空气中均匀弥散)。 中C的化合价为
中C的化合价为___________ ;实验室用 固体配制
固体配制 溶液时,应先将其溶于氢氧化钠溶液中,再用蒸馏水稀释,其目的是
溶液时,应先将其溶于氢氧化钠溶液中,再用蒸馏水稀释,其目的是___________ 。 用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是
用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是___________ 。
(2)工业制备硫代硫酸钠的反应原理: 。某化学小组利用该原理在实验室制备硫代硫酸钠。
。某化学小组利用该原理在实验室制备硫代硫酸钠。
【实验一】制备硫代硫酸钠的装置如图所示。
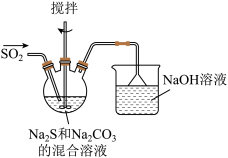
①盛放 和
和 混合溶液的仪器名称是
混合溶液的仪器名称是___________ 。
② 溶液的作用是
溶液的作用是___________ 。
【实验二】测定硫代硫酸钠产品的纯度。
制备的硫代硫酸钠产品一般为 ,可用
,可用 的标准溶液测定产品的纯度:取
的标准溶液测定产品的纯度:取 产品配制成
产品配制成 溶液,取
溶液,取 溶液,用
溶液,用 的标准溶液进行滴定(原理为
的标准溶液进行滴定(原理为 ),相关数据记录如表:
),相关数据记录如表:
③上述滴定操作中应该选用___________ 作为反应的指示剂。
④ 产品的纯度为
产品的纯度为___________ 。
(1)
(2)工业制备硫代硫酸钠的反应原理:
【实验一】制备硫代硫酸钠的装置如图所示。

①盛放
②
【实验二】测定硫代硫酸钠产品的纯度。
制备的硫代硫酸钠产品一般为
| 实验编号 | 1 | 2 | 3 |
| 溶液体积 | 25.00 | 25.00 | 25.00 |
| 消耗 | 20.05 | 18.00 | 19.95 |
④
2023·辽宁阜新·模拟预测
类题推荐
氰化钠(NaCN)是一种重要的基本化工原料,用于化学合成、电镀、冶金和有机合成医药、农药,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用二氧化氯(ClO2)水溶液或硫代硫酸钠(Na2S2O3)溶液来处理,以减轻环境污染。
I.
(1) 用二氧化氯(ClO2)水溶液处理后,
用二氧化氯(ClO2)水溶液处理后, 被氧化为
被氧化为 和
和 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
II.工业制备硫代硫酸钠的反应原理: 。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
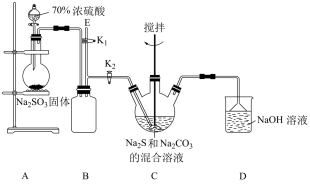
【实验一】实验室通过如图所示装置制备硫代硫酸钠。

关闭 ,打开
,打开 ,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
(2)①装置C中盛放 和
和 混合溶液的仪器名称是
混合溶液的仪器名称是___________ ;
②装置B的作用是___________ ;
③实验结束后装置D烧杯中的溶质除NaOH之外,还可能有___________ ;
(3)实验结束后,在E处可连接盛有___________(填序号)溶液的注射器,再关闭 ,打开
,打开 ,以防止拆除装置时装置中的有害气体逸出污染空气。
,以防止拆除装置时装置中的有害气体逸出污染空气。
【实验二】测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为 ,一般可用
,一般可用 的标准溶液测定产品纯度:取
的标准溶液测定产品纯度:取 产品配制成
产品配制成 溶液,取
溶液,取 溶液,用浓度为
溶液,用浓度为 的标准溶液进行滴定(原理为
的标准溶液进行滴定(原理为 ),相关数据记录如表:
),相关数据记录如表:
(4)①上述滴定操作中应该选用___________ 作为反应的指示剂;
②计算 产品的纯度为
产品的纯度为___________ 。
(5)查阅资料知氰化钠与硫代硫酸钠的反应是 ;实验室中
;实验室中 可以代替
可以代替 检验
检验___________ (填离子符号)。
I.
(1)
II.工业制备硫代硫酸钠的反应原理:
【实验一】实验室通过如图所示装置制备硫代硫酸钠。

关闭
(2)①装置C中盛放
②装置B的作用是
③实验结束后装置D烧杯中的溶质除NaOH之外,还可能有
(3)实验结束后,在E处可连接盛有___________(填序号)溶液的注射器,再关闭
| A. | B.浓硫酸 |
| C.酸性 | D. |
【实验二】测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为
| 实验编号 | 1 | 2 | 3 |
| 溶液体积/mL | |||
| 消耗 |
②计算
(5)查阅资料知氰化钠与硫代硫酸钠的反应是
氰化钠(NaCN)是一种重要的基本化工原料,用于化学合成、电镀、冶金和。有机合成医药、农药,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用二氧化。氯(ClO2)水溶液或硫代硫酸钠(Na2S2O3)溶液来处理,以减轻环境污染。
(1)NaCN用二氧化氯(ClO2)水溶液处理后,CN-被氧化为两种不污染空气的气体,该反应的离子方程式为_______ 。
工业制备硫代硫酸钠的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
[实验一]实验室通过如图所示装置制备硫代硫酸钠。
关闭K1,打开K2,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
(2)①装置C中盛放Na2S和Na2CO3混合溶液的仪器名称是_______ ;
②装置B的作用是_______ ;
(3)实验结束后,在E处可连接盛有_______(填序号)溶液的注射器,再关闭K2,打开K1,以防止拆除装置时装置中的有害气体逸出污染空气。
(4)抽滤如图2所示,与用普通漏斗过滤相比,抽滤的优点是_______ (写出其中一点);其最佳操作顺序是_______ ,确认抽干(填标号)。
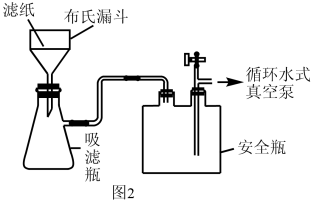
a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
[实验二]测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为Na2S2O3·5H2O,一般可用I2的标准溶液测定产品纯度:取10.00g产品配制成250mL溶液,取25.00mL溶液,用浓度为0.1000mol·L-1I2的标准溶液进行滴定(原理为2Na2S2O3+I2-=Na2S4O6+2NaI),相关数据记录如表:
(5)计算Na2S2O3·5H2O产品的纯度为_______ 。
(1)NaCN用二氧化氯(ClO2)水溶液处理后,CN-被氧化为两种不污染空气的气体,该反应的离子方程式为
工业制备硫代硫酸钠的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
[实验一]实验室通过如图所示装置制备硫代硫酸钠。

关闭K1,打开K2,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
(2)①装置C中盛放Na2S和Na2CO3混合溶液的仪器名称是
②装置B的作用是
(3)实验结束后,在E处可连接盛有_______(填序号)溶液的注射器,再关闭K2,打开K1,以防止拆除装置时装置中的有害气体逸出污染空气。
| A.BaCl2溶液 | B.浓硫酸 | C.酸性KMnO4溶液 | D.NaOH溶液 |

a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
[实验二]测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为Na2S2O3·5H2O,一般可用I2的标准溶液测定产品纯度:取10.00g产品配制成250mL溶液,取25.00mL溶液,用浓度为0.1000mol·L-1I2的标准溶液进行滴定(原理为2Na2S2O3+I2-=Na2S4O6+2NaI),相关数据记录如表:
| 实验编号 | 1 | 2 | 3 |
| 溶液体积/mL | 25.00 | 25.00 | 25.00 |
| 消耗I2的标准溶液体积/mL | 20.05 | 18.00 | 19.95 |
氰化钠(NaCN)是一种重要的基本化工原料,用于化学合成、电镀、冶金和。有机合成医药、农药,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用二氧化。氯(ClO2)水溶液或硫代硫酸钠(Na2S2O3)溶液来处理,以减轻环境污染。
(1)NaCN用二氧化氯(ClO2)水溶液处理后,CN-被氧化为两种不污染空气的气体,该反应的离子方程式为_______ 。
工业制备硫代硫酸钠的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
[实验一]实验室通过如图所示装置制备硫代硫酸钠。
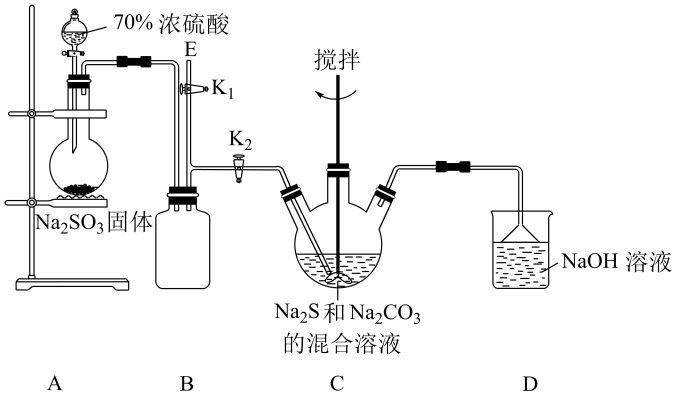
关闭K1,打开K2,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
(2)①装置C中盛放Na2S和Na2CO3混合溶液的仪器名称是_______ ;
②装置B的作用是_______ ;
③实验结束后装置D烧杯中的溶质除NaOH之外,还可能有_______ ;
(3)实验结束后,在E处可连接盛有_______(填序号)溶液的注射器,再关闭K2,打开K1,以防止拆除装置时装置中的有害气体逸出污染空气。
(4)抽滤如图2所示,与用普通漏斗过滤相比,抽滤的优点是_______ (写出其中一点);其最佳操作顺序是_______ ,确认抽干(填标号)。

a.打开循环水式真空泵
b.加入少量蒸馏水润湿滤纸
c.转移固液混合物
[实验二]测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为Na2S2O3·5H2O,一般可用I2的标准溶液测定产品纯度:取10.00g产品配制成250mL溶液,取25.00mL溶液,用浓度为0.1000mol·L-1I2的标准溶液进行滴定(原理为2Na2S2O3+I2-=Na2S4O6+2NaI),相关数据记录如表:
(5)计算Na2S2O3·5H2O产品的纯度为_______ 。
(1)NaCN用二氧化氯(ClO2)水溶液处理后,CN-被氧化为两种不污染空气的气体,该反应的离子方程式为
工业制备硫代硫酸钠的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
[实验一]实验室通过如图所示装置制备硫代硫酸钠。

关闭K1,打开K2,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
(2)①装置C中盛放Na2S和Na2CO3混合溶液的仪器名称是
②装置B的作用是
③实验结束后装置D烧杯中的溶质除NaOH之外,还可能有
(3)实验结束后,在E处可连接盛有_______(填序号)溶液的注射器,再关闭K2,打开K1,以防止拆除装置时装置中的有害气体逸出污染空气。
| A.BaCl2溶液 | B.浓硫酸 | C.酸性KMnO4溶液 | D.NaOH溶液 |

a.打开循环水式真空泵
b.加入少量蒸馏水润湿滤纸
c.转移固液混合物
[实验二]测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为Na2S2O3·5H2O,一般可用I2的标准溶液测定产品纯度:取10.00g产品配制成250mL溶液,取25.00mL溶液,用浓度为0.1000mol·L-1I2的标准溶液进行滴定(原理为2Na2S2O3+I2-=Na2S4O6+2NaI),相关数据记录如表:
| 实验编号 | 1 | 2 | 3 |
| 溶液体积/mL | 25.00 | 25.00 | 25.00 |
| 消耗I2的标准溶液体积/mL | 20.05 | 18.00 | 19.95 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


