解答题-原理综合题 适中0.65 引用1 组卷66
硫、氮是化工生产中的重要非金属元素,铁、铝是生活中重要的金属元素。回答下列相关问题。
(1)(NH4)2Fe(SO4)2•6H2O是一种重要的化工原料,用途十分广泛。一般从废铁屑中回收制备,铁屑经碱溶液洗净之后,用过量硫酸溶解。再加入稍过量硫酸铵饱和溶液,小火下蒸发溶剂直到晶膜出现,______ 、______ 、用少量乙醇洗涤。(填写实验操作)
(2)在400℃时,将一定量的SO2和14molO2充入一个盛有催化剂的10L恒容密闭容器中进行反应:2SO2+O2 2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
①2min内平均反应速率:v(O2)=______ 。
②发生反应前容器内压强与发生反应后容器中压强比值为______ 。
(3)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池放电时的总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,则该电池放电时负极反应式为______ ,_____ (填“正”或“负”)极附近溶液的碱性增强。
(4)向100mL某硝酸和硫酸的混合稀溶液中加入5.04g铁粉,恰好完全反应,只收集到一种气体,溶液中只存在一种盐,溶液取样加入硫氰化钾无血红色,则原溶液中硫酸的物质的量浓度为______ 。
(5)向某无色溶液中通入过量的HCl,先产生白色沉淀,后白色沉淀溶解,得到无色溶液,向所得无色溶液中再通入NH3至过量,试描述整个过程中的反应现象______ 。
(1)(NH4)2Fe(SO4)2•6H2O是一种重要的化工原料,用途十分广泛。一般从废铁屑中回收制备,铁屑经碱溶液洗净之后,用过量硫酸溶解。再加入稍过量硫酸铵饱和溶液,小火下蒸发溶剂直到晶膜出现,
(2)在400℃时,将一定量的SO2和14molO2充入一个盛有催化剂的10L恒容密闭容器中进行反应:2SO2+O2
①2min内平均反应速率:v(O2)=
②发生反应前容器内压强与发生反应后容器中压强比值为
(3)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池放电时的总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,则该电池放电时负极反应式为
(4)向100mL某硝酸和硫酸的混合稀溶液中加入5.04g铁粉,恰好完全反应,只收集到一种气体,溶液中只存在一种盐,溶液取样加入硫氰化钾无血红色,则原溶液中硫酸的物质的量浓度为
(5)向某无色溶液中通入过量的HCl,先产生白色沉淀,后白色沉淀溶解,得到无色溶液,向所得无色溶液中再通入NH3至过量,试描述整个过程中的反应现象
22-23高一下·河南信阳·期中
类题推荐
CH3OH是无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是___________ (填字母)。
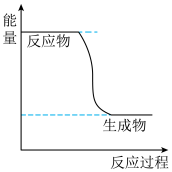
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量___________ kJ。
(3)某温度下,将10molCH3OH和4molO2充入2L的密闭容器中,经过5min反应达到平衡,测得c(O2)=0.4mol/L,5min内平均反应速率v(H2)=________ ,则CH3OH的转化率为_________ 。
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-= +6H2O,则电池放电时通入空气的电极反应式为
+6H2O,则电池放电时通入空气的电极反应式为___________ ,电池放电时,电解质溶液的碱性逐渐___________ (填“增加“减小”或“不变”)若线路中转移0.2mol电子,则消耗的O2在标准状况下的体积为___________ L。
(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是___________ 。
③下列措施不使提高反应速率的是___________ 。
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
(1)已知CH3OH(g)+

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量
| 化学键 | C一H | C一O | O一H | O=O | C=O | H一H |
| 键能/kJ | 44 | 360 | 464 | 498 | 799 | 416 |
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-=
(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是
③下列措施不使提高反应速率的是
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
回答下列问题:
(1)下列反应是氧化还原反应且是吸热反应的是____ 。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____ ,当线路中转移0.2mol电子时,则被腐蚀铜的质量为____ g。
(3)高铁电池是一种新型可充电电池,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。放电时,负极反应式为
3Zn(OH)2+2Fe(OH)3+4KOH。放电时,负极反应式为____ ,正极附近溶液的碱性____ (填“增强”“减弱”“不变”)。
(4)实验小组对可逆反应aX(g)+bY(g) pZ(g)进行探究。回答下列问题:
pZ(g)进行探究。回答下列问题:
T℃时,起始向10L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量浓度(c)与时间(t)的关系如图所示。
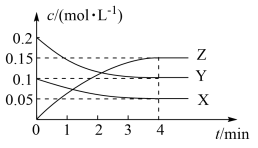
①0~4min内的反应速率v(Y)=____ 。
②为提高此反应的速率,下列措施可行的是____ (填字母代号)。
A.移出Z B.使用适合催化剂 C.降低温度 D.增大压强
③该反应达最大限度时Y的体积分数为____ 。
④下列描述能表示该反应达平衡状态的是____ 。
A.容器内的混合气体的平均相对分子质量不再改变
B.容器内压强不再发生变化
C.2v(X)=v(Y)
D.X的体积分数不再改变
(1)下列反应是氧化还原反应且是吸热反应的是
| A.稀醋酸与烧碱溶液反应 | B.灼热的炭与CO2的反应 |
| C.铁片与稀盐酸的反应 | D.Ba(OH)2•8H2O与NH4Cl的反应 |
(3)高铁电池是一种新型可充电电池,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O
(4)实验小组对可逆反应aX(g)+bY(g)
T℃时,起始向10L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量浓度(c)与时间(t)的关系如图所示。

①0~4min内的反应速率v(Y)=
②为提高此反应的速率,下列措施可行的是
A.移出Z B.使用适合催化剂 C.降低温度 D.增大压强
③该反应达最大限度时Y的体积分数为
④下列描述能表示该反应达平衡状态的是
A.容器内的混合气体的平均相对分子质量不再改变
B.容器内压强不再发生变化
C.2v(X)=v(Y)
D.X的体积分数不再改变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH

