解答题-原理综合题 适中0.65 引用1 组卷98
阿根廷科学家MasVeronica等人利用Ni(Ⅱ)Al(Ⅲ)层状复合催化剂进行了乙醇水蒸气重整制氢的研究。其主要反应为
反应I.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H1=+173.3kJ/mol △S=+362.7J/(K•mol)
反应Ⅱ.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H2=+255.7kJ/mol
若在恒容密闭容器中发生上述反应。
(1)反应I在常温下
(2)对上述恒容密闭容器中的体系,下列说法正确的是
| A.增大H2O(g)的浓度,有利于提高C2H5OH平衡转化率 |
| B.一定温度下,增大C2H5OH的浓度可以提高C2H5OH的平衡转化率 |
| C.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| D.升高温度可以使反应I、Ⅱ的正反应速率加快,逆反应速率减小,平衡向正反应方向移动 |
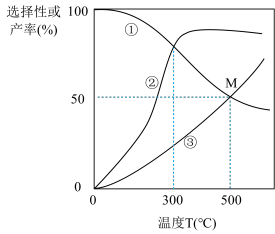
①图中曲线表示平衡时H2产率随温度变化的曲线是
②在密闭容器中,以投料比n(C2H5OH):n(H2O)=3:8通入混合气体,此时C2H5OH的转化率为66.67%,求交点M坐标为(500℃,50%)时反应Ⅱ的平衡常数Kp=
③一定能提高CO选择性的关键因素是
④请分析说明曲线②随温度变化的原因
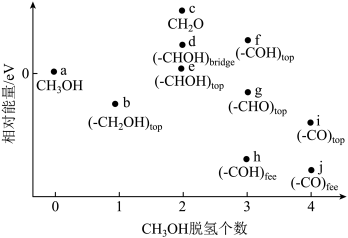
(4)对乙醇水蒸气重整制氢反应I进行反应机理分析如下,“*”表示催化剂表面的活性中心,请补充完成基元反应iii。
i.C2H6O(g)+(*)→C2H6O*
ii.C2H6O*+(*)→CH4O*+CH2*
ⅲ.
iv.CH2*+2H2O(g)→CO2(g)+3H2(g)+(*)
22-23高二下·湖北·期中
类题推荐
氢气的制取与储存是氢能源利用领域的研究热点。CH4-H2O(g)催化重整制氢,主要反应如下:
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:
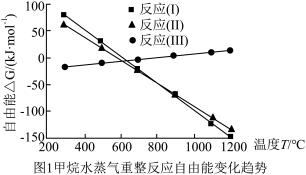
(1)反应Ⅱ焓变的符号:∆H2_______ 0(填“>”或“<”),理由是_______ 。
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是_______ 。
(3)反应Ⅲ的速率v=v正-v逆=k正c(CO)•c(H2O)-k逆c(CO2)•c(H2),其中k正、k逆分别为正、逆反应速率常数。升高温度时lgk正-lgk逆_______ (填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为_______ MPa(用含a、b的代数式表示,下同)。
②反应I的Kp=_______ (用平衡时各物质的分压代替物质的量浓度)。
(5)70~80℃,利用HCO 与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
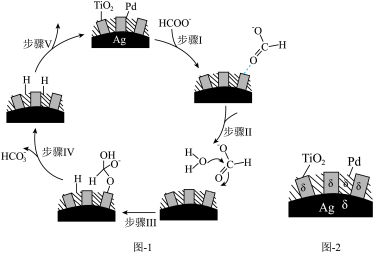
①写出释氢反应的离子方程式:_______ 。
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为_______ 。
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:

(1)反应Ⅱ焓变的符号:∆H2
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是
| A.及时分离出二氧化碳,可以使得反应I的正反应速率增大 |
| B.降低温度,反应I逆向移动,反应Ⅲ正向移动 |
| C.加入反应Ⅲ的催化剂,可以降低该反应的活化能和反应热 |
| D.增大水蒸气的浓度,有利于提高甲烷的平衡转化率 |
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为
②反应I的Kp=
(5)70~80℃,利用HCO

①写出释氢反应的离子方程式:
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网