解答题-原理综合题 适中0.65 引用1 组卷61
学习化学反应原理能够指导促进人类生活质量的提高。
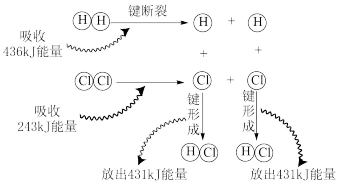
(1)氢气是最理想的能源。1g氢气完全燃烧放出热量121.6kJ,其中断裂1mol H-H键吸收436kJ,断裂1mol O=O键吸收496kJ,则形成1mol H-O键放出热量_______ kJ。
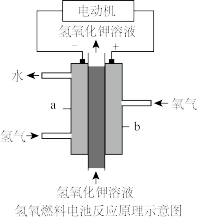
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某兴趣小组拟将刻蚀电路板的反应2FeCl3+Cu=2FeCl2+CuCl2设计成原电池,则负极所用电极材料为_______ ,当线路中转移0.4mol电子时,则被腐蚀铜的质量为_______ g。
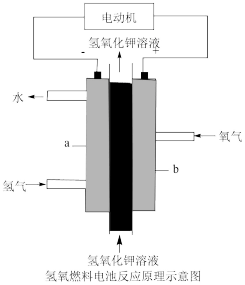
(3)CH4—空气碱性燃料电池的能量转化率高,某甲烷燃料电池如图所示。放电时,电子由铂极流出,经电流表流向石墨电极。
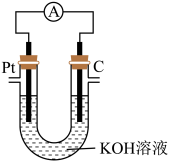
①在石墨电极附近充入_______ (填“CH4”或“空气”)。
②铂极上发生反应的电极反应式为_______ 。
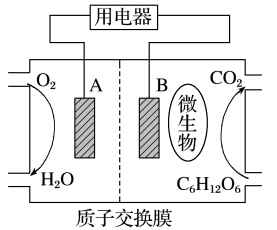
(4)在开始工作的Zn、Cu原电池中,电解质的稀溶液中含CuSO4、H2SO4各0.100mol,则:当电路中通过的电子在0.200~0.300mol时,正极发生的电极反应式是_______ ;当电路中通过0.300mol电子时,电池中共产生标准状况下的气体_______ L。
(1)氢气是最理想的能源。1g氢气完全燃烧放出热量121.6kJ,其中断裂1mol H-H键吸收436kJ,断裂1mol O=O键吸收496kJ,则形成1mol H-O键放出热量
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某兴趣小组拟将刻蚀电路板的反应2FeCl3+Cu=2FeCl2+CuCl2设计成原电池,则负极所用电极材料为
(3)CH4—空气碱性燃料电池的能量转化率高,某甲烷燃料电池如图所示。放电时,电子由铂极流出,经电流表流向石墨电极。

①在石墨电极附近充入
②铂极上发生反应的电极反应式为
(4)在开始工作的Zn、Cu原电池中,电解质的稀溶液中含CuSO4、H2SO4各0.100mol,则:当电路中通过的电子在0.200~0.300mol时,正极发生的电极反应式是
22-23高一下·江西抚州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网