解答题-原理综合题 较难0.4 引用2 组卷92
近年来,改善环境是科学研究的重要课题,对实现碳循环及废气资源的再利用技术的发展都具有重要意义。
(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1 K1
CH3OH(g)+H2O(g) △H1 K1
Ⅱ.CO(g)+2H2(g) CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) △H3 K3
CO(g)+H2O(g) △H3 K3
则△H2=______ (用含△H1、△H3的代数式表示),K2=______ (用含K1、K3的代数式表示)。
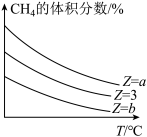
(2)一定条件下,CH4和H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H,设起始
CO(g)+3H2(g) △H,设起始 =Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是______ (填标号)。
(3)在T1℃时,往10L的某恒容密闭容器中充入3molCH4(g)和5molH2O(g),发生反应CH4(g)+H2O(g) CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
①0~5min内,v(H2)=______ mol•L-1•min-1,H2O(g)的平衡转化率为______ %。
②该反应的平衡常数K=______ (mol•L-1)2。
③反应达到平衡时,再充入1molH2O(g)和2molCO(g),此时v正______ (填“>”、“<”或“=”)v逆。
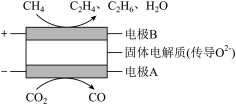
(4)CH4和CO2都是比较稳定的分子,科学家利用化学装置实现两种分子的耦合转化,其原理如图所示。若生成乙烯和乙烷的体积比为7∶3,则消耗CH4和CO2的体积比为______ 。
(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)
Ⅱ.CO(g)+2H2(g)
Ⅲ.CO2(g)+H2(g)
则△H2=
(2)一定条件下,CH4和H2O(g)发生反应:CH4(g)+H2O(g)

| A.若氢气的物质的量分数不再随时间而改变,则该反应达到平衡 |
| B.加入合适的催化剂,该反应的平衡转化率和△H的值均增大 |
| C.当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡 |
| D.a>3>b |
①0~5min内,v(H2)=
②该反应的平衡常数K=
③反应达到平衡时,再充入1molH2O(g)和2molCO(g),此时v正
(4)CH4和CO2都是比较稳定的分子,科学家利用化学装置实现两种分子的耦合转化,其原理如图所示。若生成乙烯和乙烷的体积比为7∶3,则消耗CH4和CO2的体积比为

22-23高二下·河南周口·阶段练习
类题推荐
研究CO2的利用对构建低碳社会具有重要的意义。在一定条件下将CO2和H2转化为CH3OH和H2O(g)的相关反应有:
a.CO2(g)+ H2(g) CO(g)+H2O(g) ΔH1=- 38 kJ·mol-1;
CO(g)+H2O(g) ΔH1=- 38 kJ·mol-1;
b.CO(g)+ 2H2(g) CH3OH(g) ΔH2=-x kJ·mol-1;
CH3OH(g) ΔH2=-x kJ·mol-1;
c.CO2(g) + 3H2(g) CH3OH(g)+H2O(g) ΔH3=- 137 kJ·mol-1。
CH3OH(g)+H2O(g) ΔH3=- 137 kJ·mol-1。
已知:①反应中部分化学键的键能数据如表所示。
②x为大于零的数。
回答下列问题:
(1)反应c中C-O键的键能为___________ kJ·mol-1,反应b中每生成0.3 mol C- H键,该反应放出的热量为___________ kJ。
(2)对于反应b,在___________ (填“高温”、 “低温”或“任意温度”)下有利于该反应自发进行,判断的理由是___________ 。
(3)某温度下,向4 L的恒容密闭容器中,充入0. 2 mol CO2和0.8 mol H2,仅发生反应a和c,5min后。反应达到平衡,此时,测得平衡时混合气体的压强为起始压强的0.68倍,CO的物质的量为平衡时总物质的量的 。
。
①0~5 min内,v(H2)=___________ mol·L-1·min-1。
②CO2的转化率为___________ %,c(CH3OH)=___________ mol·L-1。
③反应达到平衡后,若此时的压强为p MPa,则反应c的平衡常数Kp=___________ (列出计算式即可,以分压表示,分压=总压×物质的量分数)。
④下列说法正确的是___________ (填标号)。
A.仅及时移除部分产物H2O(g),反应a和c的平衡常数均增大
B.仅升高温度,ΔH1和ΔH3的值保持不变
C.当混合气体的密度不再随时间变化时,反应a和c达到平衡
D.每消耗0. 1 mol CO2的同时消耗0. 1 mol H2O(g),则反应a和c达到平衡
a.CO2(g)+ H2(g)
b.CO(g)+ 2H2(g)
c.CO2(g) + 3H2(g)
已知:①反应中部分化学键的键能数据如表所示。
| 化学键 | C=O | H-H | C-H | O- H |
| 键能/(kJ·mol -1) | 745 | 436 | 413 | 463 |
②x为大于零的数。
回答下列问题:
(1)反应c中C-O键的键能为
(2)对于反应b,在
(3)某温度下,向4 L的恒容密闭容器中,充入0. 2 mol CO2和0.8 mol H2,仅发生反应a和c,5min后。反应达到平衡,此时,测得平衡时混合气体的压强为起始压强的0.68倍,CO的物质的量为平衡时总物质的量的
①0~5 min内,v(H2)=
②CO2的转化率为
③反应达到平衡后,若此时的压强为p MPa,则反应c的平衡常数Kp=
④下列说法正确的是
A.仅及时移除部分产物H2O(g),反应a和c的平衡常数均增大
B.仅升高温度,ΔH1和ΔH3的值保持不变
C.当混合气体的密度不再随时间变化时,反应a和c达到平衡
D.每消耗0. 1 mol CO2的同时消耗0. 1 mol H2O(g),则反应a和c达到平衡
研究碳及其化合物的资源化利用具有重要的意义。回答下列问题:
(1)已知下列热化学方程式:
反应Ⅰ:CO2(g)+4H2(g) = CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应Ⅱ:CO2(g)+H2(g)= CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g)= CO(g)+3H2(g)的ΔH3=_______ kJ/mol。
(2)在T℃时,将1molCO2和3molH2加入容积不变的密闭容器中,发生反应Ⅰ:CO2(g)+4H2(g) CH4(g)+2H2O(g),实验测得CO2的体积分数φ(CO2)如表所示:
CH4(g)+2H2O(g),实验测得CO2的体积分数φ(CO2)如表所示:
①能判断反应CO2(g)+4H2(g) CH4(g)+2H2O(g)达到平衡的是
CH4(g)+2H2O(g)达到平衡的是_______ (填标号)。
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为_______ %(结果保留三位有效数字)。
(3)在T℃时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g) HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始
HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始 的关系如图所示:(分压=总压×物质的量分数)
的关系如图所示:(分压=总压×物质的量分数)
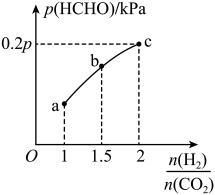
①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=_______ mol/(L·min)。
②b点时反应的平衡常数Kp=_______ (kPa)-1(以分压表示)。
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率_______ (填“增大”“不变”或减小”)。
(1)已知下列热化学方程式:
反应Ⅰ:CO2(g)+4H2(g) = CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应Ⅱ:CO2(g)+H2(g)= CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g)= CO(g)+3H2(g)的ΔH3=
(2)在T℃时,将1molCO2和3molH2加入容积不变的密闭容器中,发生反应Ⅰ:CO2(g)+4H2(g)
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO2) | 0.25 | 0.23 | 0.214 | 0.202 | 0.200 | 0.200 |
①能判断反应CO2(g)+4H2(g)
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为
(3)在T℃时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g)

①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=
②b点时反应的平衡常数Kp=
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率
研究碳及其化合物的资源化利用具有重要的意义。回答下列问题:
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH3=
CO(g)+3H2(g)的ΔH3=_______ kJ/mol。
(2)在T°C时,将1molCO2和3molH2加入容积不变的密闭容器中,发生反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g),实验测得CO2的体积分数φ(CO2)如表所示:
CH4(g)+2H2O(g),实验测得CO2的体积分数φ(CO2)如表所示:
①能判断反应CO2(g)+4H2(g) CH4(g)+2H2O(g)达到平衡的是
CH4(g)+2H2O(g)达到平衡的是_______ (填标号)。
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为_______ %(结果保留三位有效数字)。
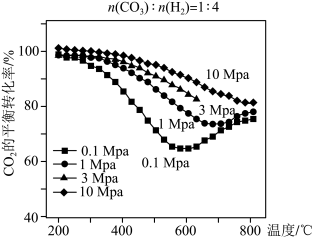
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是_______ 。
(4)在T°C时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g) =HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始
=HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始 的关系如图所示:(分压=总压×物质的量分数)
的关系如图所示:(分压=总压×物质的量分数)

①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=_______ mol/(L·min)。
②b点时反应的平衡常数Kp=_______ (kPa)-1(以分压表示)。
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率_______ (填“增大”“不变”或减小”)。
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g)
反应II:CO2(g)+H2(g)
则反应CH4(g)+H2O(g)
(2)在T°C时,将1molCO2和3molH2加入容积不变的密闭容器中,发生反应I:CO2(g)+4H2(g)
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(CO2) | 0.25 | 0.23 | 0.214 | 0.202 | 0.200 | 0.200 |
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是

(4)在T°C时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g)

①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=
②b点时反应的平衡常数Kp=
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


